- シンクタンクならニッセイ基礎研究所 >
- 経営・ビジネス >
- 法務 >
- 医学研究にかかわる倫理指針-個人情報保護法とインフォームドコンセント
医学研究にかかわる倫理指針-個人情報保護法とインフォームドコンセント

保険研究部 研究理事 兼 ヘルスケアリサーチセンター長 松澤 登
文字サイズ
- 小
- 中
- 大
学術研究機関等が他の学術研究機関に既存試料・情報を提供する場である。この場合、既存の試料と要配慮個人情報を提供する場合は、研究対象者から文書IC、または口頭でのIC と記録をとることが原則である。ただし、提供先に個人を識別できないようにして情報を提供する場合などでは特例がある。要配慮個人情報を含まない情報提供においては、ICは原則として不要であり、提供先で個人情報とならないもの(個人関連情報)や匿名加工情報である場合、追加的手続は不要である。
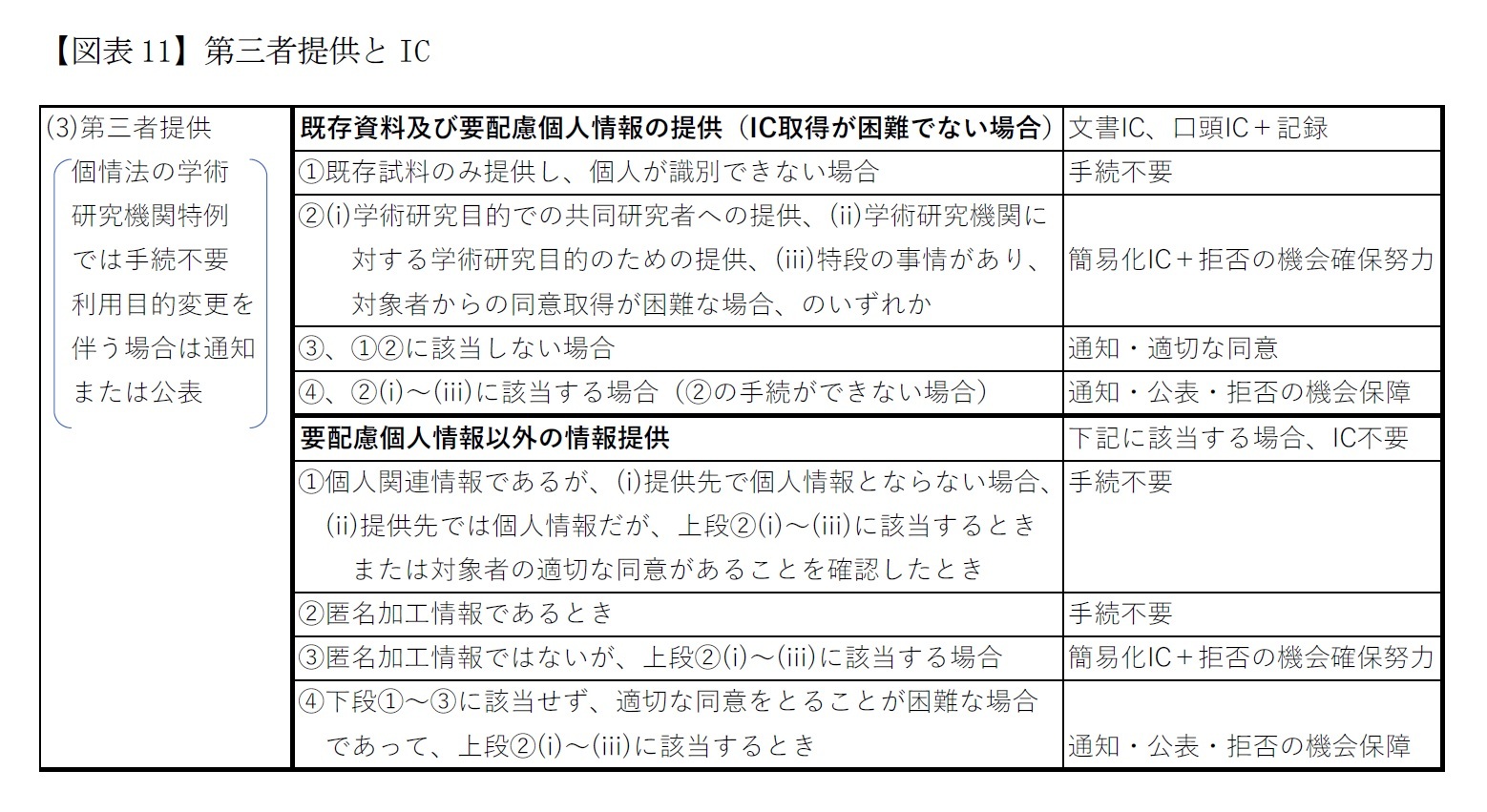
具体的には(1)既存の試料及び要配慮個人情報の提供を行う場合には、口頭ICとその記録を残すことを原則とする。これが困難な場合に限り、①既存の試料のみを提供する場合において個人が識別されない方式での提供には手続不要である。②個人が識別される場合であって、IC取得困難ではあるが、変更後の目的が当初目的と関連性が合理的にある場合は本人への通知または公表で利用が可能である。そして③(i)学術研究目的での共同研究者への情報提供、(ⅱ)学術研究機関に対する学術研究目的のための情報提供、(ⅲ)特段の事情があり研究対象からの同意取得が困難な場合(以上(i)~(ⅲ)を学術研究機関特例という)は、研究対象者に拒否の機会を与えるように努め、かつ簡易化したICの取得(第9(1)(2))20を行うことにより第三者提供ができる。さらに、④学術研究機関特例に該当するときであってIC取得が困難である場合には、研究対象者が拒否できる機会を保障することで、第三者提供が可能である(第8の1(3)ア)。
他方、(2)要配慮個人情報以外の情報については、第三者提供しようとする学術研究機関等にはIC取得の義務はない。ただし、①情報が個人関連情報であって、(i)提供先で個人情報となることが想定されない場合、提供先で個人情報になる場合であっても、(ⅱ)学術研究機関特例に該当する場合、(ⅲ)提供先で同意を得ていることを確認している場合には手続不要である。また、②匿名加工情報であるときにも手続が不要である。そして③匿名加工情報ではないが学術研究機関特例に該当する場合には、本人に拒否の機会を確保するように努め、かつ簡易ICを行うことで提供が可能である。さらに④、①~③以外で学術研究機関特例に該当し、かつ研究対象者の同意を取得するのが困難なときには、研究対象者へ通知・公表し、研究対象者が拒否できる機会を保障する場合においては、第三者である学術研究機関へ提供できる(第8の1(3)イ)(図表11)。なお、個情法の学術研究機関特例においては手続不要であるが、利用目的の変更を伴う場合には本人への通知または公表が必要である。
20 侵襲を行わないようなケースにおいて、広報を行うとともに研究対象者に事後的説明を行うことなどが定められている(第8の9)
上記4|で述べた手続を経て第三者提供を受けて研究を実施する場合には、提供を受けた研究者は、(1)提供元で取られた試料・情報についてのICの手続、ICが省略出来るときにとられた手続について確認する。また、(2)提供元で簡易化されたICを受けたときは、提供元での手続の確認と簡易化IC手続の履行、さらに(3)通知+適切な同意で提供された場合、および提供元で拒否できる機会を保障して第三者提供された情報については、提供元の手続の確認と研究対象者が拒否できる機会を保障することが必要となる(第8の1(5)イ)。
5――ICと個情法上の同意
繰り返しとはなるが、ICとは、研究対象者等が、実施または継続されようとする研究に関して、当該研究の目的及び意義並びに方法、研究対象者に生じうる負担、予測される結果(リスク及び利益を含む)等について研究者等又は既存試料・情報の提供のみを行う者から十分な説明を受け、それらを理解したうえで自由意思について基づいて研究者等又は既存試料・情報の提供のみを行う者に対して与える、当該研究(試料・情報の取扱い含む)を実施または継続されることに関する同意をいう(指針第2(20))。もともとICは、世界医師会が医療・医学研究に携わる当事者が遵守すべきルールを定めたヘルシンキ宣言(1964年)に基づく。
研究領域におけるICは医療行為におけるICと異なり、当人の治療のために取得されるものではないことから、臨床医療におけるICよりも慎重にとるべきものと考えられている。また、医療研究目的のICは過去にナチスによる人体実験などの悲惨な経験に基づいているため、人格の尊厳確保に加え、医療研究倫理の観点からも重要視されている。
そのため、可能であれば文書あるいは口頭でICをとることを原則としつつ、これが困難な場合は代替的手段で(推定的なものであっても)本人同意があったといいうるようにすることが企図されている。ただし、上述した通り、ルールは複雑であって、このような企図が、そうでなくとも多忙な医師にきちんと理解され、ルール通りにICが取得されているか運営されているかについては疑問が残らざるを得ない21。これは運営よりも制度設計の問題であって、本人のICですべてを正当化しようということに無理があると言えるかもしれない。最初の身体精神に影響を与える侵襲・介入を行う際(1次取得)のICと、その後の情報の流れについて同意を与えるICには質の違いがあると思われ22、たとえば1次取得より後の情報の流れについては個情法にルールをそろえることも検討可能ではないかと思われる。
21 米村ほか「医療・医学研究における個人情報保護と利活用の未来」(ジュリスト2018年冬号)P151、田代志門氏発言部分参照。
22 個人情報保護の観点からは曽我部真裕「個人情報保護と医療・医学研究」(ジュリスト2018年冬号、p110)が参考になる。
個人情報保護法での個人情報の利用については、個人情報取扱事業者が利用目的を特定したうえで、その情報が要配慮個人情報であれば、本人同意を事業者が取得することとされている(個情法20条2項)。また第三者提供にあたっても個人情報を当初取得した個人情報取扱事業者が本人から同意を取得する(個情法27条1項)。
他方、指針では、研究実施にあたってICを取得すべき責任者は研究を実施すべき研究者等とされている(指針第8の1)。研究者等とは研究責任者その他の研究の実施(試料・情報の収集・提供を行う機関における業務の実施を含む)に携わる者(指針第2(17))とされている。特に研究責任者は研究の統括者として研究計画に記載される。そして研究者等は研究機関の長の許可を受けた研究計画書によりICを得ることとされている(指針第8の1)。
このように研究機関といった団体・法人ではなく、責任者である研究者等個人にIC取得の義務を負わせるのは、法人である学術研究機関での分業ではなく、勤務先は異なるが同じ大学の医局に属する研究者等により、勤務先機関をまたいだ研究者等のネットワークで共同研究が行われることも多い事情も反映していると思われる。
ただ、このような相違により、取得された情報を研究者等が保有するのか、法人としての学術研究機関等が保有するのかがあいまいになっている。たとえば、研究者Aが取得した試料・情報を、同一学術研究機関等に属する研究者Bが利用する場合には、個情法では本人同意は不要となる(=研究所単位でみる)が、指針では改めて研究者Bによる研究対象者からの口頭IC+記録が原則として必要(=研究者単位でみる)となっている(上記4の3|)。
学術研究機関においては、情報の保有主体として法人単位でみることは自明ではないようである23が、企業においては、内部者情報などを別として守秘義務が個人単位に課せられているわけではない24。なお、今回の指針改正においては、個人情報保護の主体として研究機関の長として指定されている(第13等)が、研究機関の長と研究者等との役割分担が必ずしも明確ではないように思われる。
23 前掲注20 P149、吉峰耕平氏発言部分参照。
24 医療・介護関係事業者における個人情報保護の適切な取り扱いのためのガイダンス(個人情報保護委員会、厚生労働省)P50参照。
たとえば新型コロナワクチンを未成年者にも接種するための治験であったり、あるいは認知症の人向けの医薬品の開発段階における治験が必要であったりする場合には、必ずしも本人がICを与える能力が十分でない場合も考えられる。この場合、指針では代諾者という制度がある。本人に代わって承諾するという制度であるが、あわせてインフォームドアセントという制度がある。これはICをすることができない未成年者や認知症の人などを念頭に、ICを与える能力を欠くと客観的に判断される研究対象者が、実施または継続されようとする研究に関して、その理解力に応じたわかりやすい言葉で説明を受け、当該研究を実施又は継続されることを理解し、賛意を表することをいうとされている(第2(23))。意識を失っている人については代諾者の同意しか取得しようがないが、未成年者あるいは認知症の人ということで機械的に代諾者制度を用いるのではなく、あわせてインフォームドアセントを積極的に活用すべきものと思われる。
6――おわりに
本文で見た通り、ICは自身の情報の利活用や流通について同意を与えるにとどまらず、自身の健康にも影響のある行為についての同意を意味する。ここで留意すべきは医療についてのリスクは説明されたとしても十分に理解できるかどうかについては、人にもよるが、かなり慎重目に見ておく必要がある。同意が万能ではないことはほかの業界においてもしばしば語られることではあるが、医療分野ではより深刻な問題である。このために研究計画を策定し、倫理審査委員会の審査を必要とすることは単なる手続ではなく実質的な意味を持っているといえよう。
(2022年05月30日「基礎研レポート」)

03-3512-1866
- 【職歴】
1985年 日本生命保険相互会社入社
2014年 ニッセイ基礎研究所 内部監査室長兼システム部長
2015年4月 生活研究部部長兼システム部長
2018年4月 取締役保険研究部研究理事
2021年4月 常務取締役保険研究部研究理事
2024年4月 専務取締役保険研究部研究理事
2025年4月 取締役保険研究部研究理事
2025年7月より現職
【加入団体等】
東京大学法学部(学士)、ハーバードロースクール(LLM:修士)
東京大学経済学部非常勤講師(2022年度・2023年度)
大阪経済大学非常勤講師(2018年度~2022年度)
金融審議会専門委員(2004年7月~2008年7月)
日本保険学会理事、生命保険経営学会常務理事 等
【著書】
『はじめて学ぶ少額短期保険』
出版社:保険毎日新聞社
発行年月:2024年02月
『Q&Aで読み解く保険業法』
出版社:保険毎日新聞社
発行年月:2022年07月
『はじめて学ぶ生命保険』
出版社:保険毎日新聞社
発行年月:2021年05月
松澤 登のレポート
| 日付 | タイトル | 執筆者 | 媒体 |
|---|---|---|---|
| 2025/10/28 | 東宝の自己株式取得-公開買付による取得 | 松澤 登 | 研究員の眼 |
| 2025/10/22 | 米連邦地裁、Googleへの是正措置を公表~一般検索サービス市場における独占排除 | 松澤 登 | 基礎研レポート |
| 2025/10/15 | 芝浦電子の公開買付け-ヤゲオのTOB成立 | 松澤 登 | 研究員の眼 |
| 2025/10/09 | ソニーのパーシャル・スピンオフ-ソニーフィナンシャルの分離・上場 | 松澤 登 | 研究員の眼 |
新着記事
-
2025年11月04日
数字の「26」に関わる各種の話題-26という数字で思い浮かべる例は少ないと思われるが- -
2025年11月04日
ユーロ圏消費者物価(25年10月)-2%目標に沿った推移が継続 -
2025年11月04日
米国個人年金販売額は2025年上半期も過去最高記録を更新-但し保有残高純増は別の課題- -
2025年11月04日
パワーカップル世帯の動向(2)家庭と働き方~DINKS・子育て・ポスト子育て、制度と夫婦協働が支える -
2025年11月04日
「ブルー寄付」という選択肢-個人の寄付が果たす、資金流入の突破口
お知らせ
-
2025年07月01日
News Release
-
2025年06月06日
News Release
-
2025年04月02日
News Release
【医学研究にかかわる倫理指針-個人情報保護法とインフォームドコンセント】【シンクタンク】ニッセイ基礎研究所は、保険・年金・社会保障、経済・金融・不動産、暮らし・高齢社会、経営・ビジネスなどの各専門領域の研究員を抱え、様々な情報提供を行っています。
医学研究にかかわる倫理指針-個人情報保護法とインフォームドコンセントのレポート Topへ















 各種レポート配信をメールでお知らせ。読み逃しを防ぎます!
各種レポート配信をメールでお知らせ。読み逃しを防ぎます!




