- シンクタンクならニッセイ基礎研究所 >
- 社会保障制度 >
- 医療保険制度 >
- 先駆的医薬品の開発促進-世界に先駆ける革新的な医薬品づくりの下地は整備されたか?
先駆的医薬品の開発促進-世界に先駆ける革新的な医薬品づくりの下地は整備されたか?

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員 篠原 拓也
文字サイズ
- 小
- 中
- 大
1――はじめに
日本では、著明な有効性が見込まれる革新的な医薬品について、優先審査や早期承認を図る仕組みが試行されてきた。関連法令が改正され、2021年度より、「先駆的医薬品等指定制度」として、新たに法制化された。本稿では、その内容を概観していくこととしたい。
2――指定制度の新たな法制化
1 第2段階としては、2021年8月に、添付文書の電子的な方法による提供の原則化、地域連携薬局の導入、虚偽・誇大広告による医薬品等の販売に対する課徴金制度の創設などが行われる予定。第3段階としては、2022年12月に、トレーサビリティーの向上のために、医薬品等の包装等へのバーコード等の表示の義務付けが行われる予定。
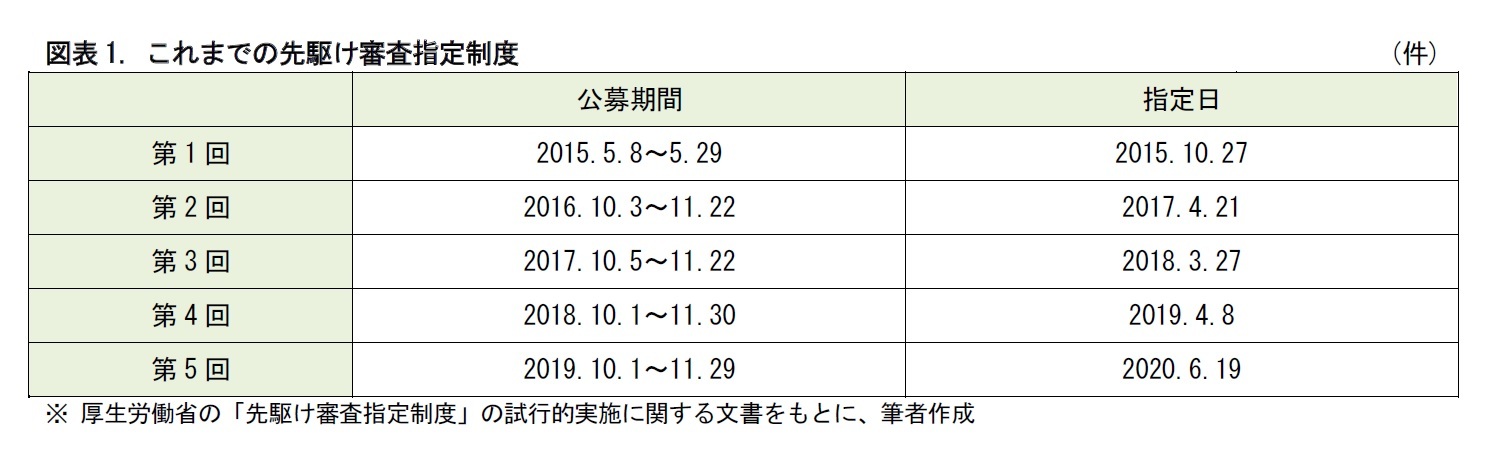
厚生労働省は、2015年度から、「先駆け審査指定制度」を試行的に運用してきた。この制度は、世界に先駆けて日本で開発され、早期の治験段階で著明な有効性が見込まれる革新的な医薬品などについて、優先的に審査し、早期の承認を目指すことが、目的とされている。
医薬品や医療機器のメーカーにとって、開発承認を目指している医薬品等が、この審査の対象に指定されると、優先審査などの審査の優遇が行われる。また、承認後の新薬の薬価算定で、「先駆け審査指定制度加算」という薬価の上乗せが行われるメリットもある。(制度の詳細は、次章参照)
そのため、国内外の医薬品メーカーや医療機器メーカーの関心を惹きつけ、開発促進に役立つものとみられていた。今回、この制度が「先駆的医薬品等指定制度」として法制化された。
法制化された新制度では、医薬品メーカー等からの申請を常時受け付けるよう、公募期間の通年化が行われた。指定については、4月頃と10月頃の年2回程度のタイミングを設ける方針が示された。
3――新たな指定制度の概要
1|世界に先駆けて日本で開発されることが指定の条件
制度では指定基準として、4つの要件が示されている。先駆的医薬品の指定を受けるためには、これらの4要件を満たすことが必要となる。
(1) 治療薬の画期性 : 原則として、以下のいずれかに該当するものであること
・既承認薬と異なる新作用機序であること2
・既承認薬と同じ作用機序であっても開発対象とする疾患への適応は初めてであること
・革新的な薬物送達システムを用いていること
(2) 対象疾患の重篤性 : 以下のいずれかに該当するものであること
・生命に重大な影響がある重篤な疾患
・根治療法がなく症状(社会生活が困難な状態)が継続している疾患
(3) 対象疾患に係る極めて高い有効性 :
既承認薬が存在しない、又は既承認薬・治療法に比べて有効性の大幅な改善が見込まれる、若しくは著しい安全性の向上が見込まれること。ただし、有効性の大幅な改善が見込まれるものについては、少なくとも国内外を問わず探索的臨床試験等において、ヒトに対する有効性が示唆されていること。
(4) 世界に先駆けて日本で早期開発・申請する意思・体制 :
日本における早期開発を重視し、世界(日本と同等の水準の承認制度を有している国)に先駆けて、又は同時に、日本で承認申請される予定のもの3であり、独立行政法人医薬品医療機器総合機構(以下、「PMDA」4)で実施されている先駆け総合評価相談を活用し承認申請できる体制及び迅速な承認審査に対応できる体制を有していること5。
2 作用機序とは、医薬品が、薬理学上の治療効果を発揮するための特異的な生化学的相互作用を指す。通常、薬がどの標的分子(タンパク質)と相互作用して、どのような影響を与えた結果、治療効果が得られるのか、分子レベルで言及する。
3 世界で最も早いか、又は日本と他国で同時に承認申請することが要件の1つとされている。ただし、医薬品メーカーの申請書類の準備などを考慮して、最初の国の申請日を起算日とし、同日から30日以内の申請は同時申請とみなすこととされた。また、申請日と申請受理日が存在する国においては、申請受理日を起算日とする。なお、法制化前の制度では、日本と他国で同時申請する場合、基本的には、同日に申請することとされていた。
4 PMDAは、Pharmaceuticals and Medical Devices Agencyの略。医薬品などの健康被害救済、承認審査、安全対策の3つの役割を担っている。(同法人のホームページより)
5 なお、国内での開発が着実に進んでいることが確認できる、以下の両方に該当する治療薬であることが望ましいとされている。(a) ヒトでの最初の試験(First In Human (FIH) 試験)が日本で行われたもの。(b) 予想される薬物の効果が示されるかどうかを判定する試験(Proof Of Concept (POC) 試験)が日本で行われたもの。
この制度で先駆的医薬品の指定を受けると、承認期間までの短期化や、開発促進の取組みという、優遇を受けることができる。
承認期間までの短期化としては、つぎの3つが挙げられる。
(1) 優先相談 (2ヵ月→1ヵ月) : 優先対面助言、随時募集対応とすることで、事実上1ヵ月で実施。
(2) 事前評価の充実 (実質的な審査の前倒し) : 事前評価を充実させる。
(3) 優先審査 (12ヵ月→6ヵ月) : 審査期間の目標を6か月に。(事前評価による審査の前倒し)
一方、開発促進の取組みとしては、つぎの2つが示されている。
(4) 審査パートナー制度 (PMDA版コンシェルジュ) :
専任の担当部長級職員をコンシェルジュとして指定。節目ごとに進捗確認等を行い、必要な部署との連絡調整を行うことにより、円滑な開発を促進する。
(5) 製造販売後の安全対策充実 (再審査期間の延長) :
法律に基づき、再審査期間を延長し、最長10年までの範囲内で設定する。
この制度の指定を受けた新薬が承認されると、薬価算定において、薬価の加算が行われる。
一般に、新薬の薬価の算定方法は、その医薬品に効能・効果や薬理作用が似た類似薬があるかどうかによって、大きく「類似薬効比較方式」と「原価計算方式」に分かれる。
類似薬効比較方式で薬価が決定される場合、類似薬と比べて新規性が高いと、補正加算が行われる。その加算1つとして、2016年度より「先駆け審査指定制度加算」が導入されている。加算率は、10%を基本としつつ、国内臨床試験の成績が充実しているものについては20%まで引き上げられる。
一方、原価計算方式で薬価が算定される場合は、計算に用いる営業利益率に加算分を加味して評価が行われる6。
なお、2020年度の薬価改正では、既に薬価収載された医薬品に対して薬価の引き下げを猶予する「新薬創出・適応外薬解消等促進加算」の対象品目に、この制度の指定品目が加わった。新薬の薬価設定時に加え、薬価改正時の引き下げ猶予という形でも、薬価面での優遇が受けられることとされている。
6 加算率は他の要素と合わせて、5%~100%となる。
4――従来の指定制度のこれまでの活用状況
7 CDERは、Center for Drug Evaluation and Researchの略。CBERは、Center for Biologics Evaluation and Researchの略。いずれも、食品医薬品局(Food and Drug Administration, FDA)の組織。
8 「承認」は、過年度分の承認も含んでいるため、各年度の「申請」~「取下げ」の欄と、「承認」の欄の数字が対応しているわけではない点に、注意が必要。
9 EEAは欧州経済領域、EFTAは欧州自由貿易連合を指す。
10 EMAは、European Medicines Agency の略。加盟国が個別に承認を与えた場合に、医薬品メーカー等に生じうるコストを削減する効果があるとされる。
11 アメリカと同様、「承認」は、過年度分の承認も含んでいるため、各年度の「申請」~「却下」の欄と、「承認」の欄の数字が対応しているわけではない点に、注意が必要。
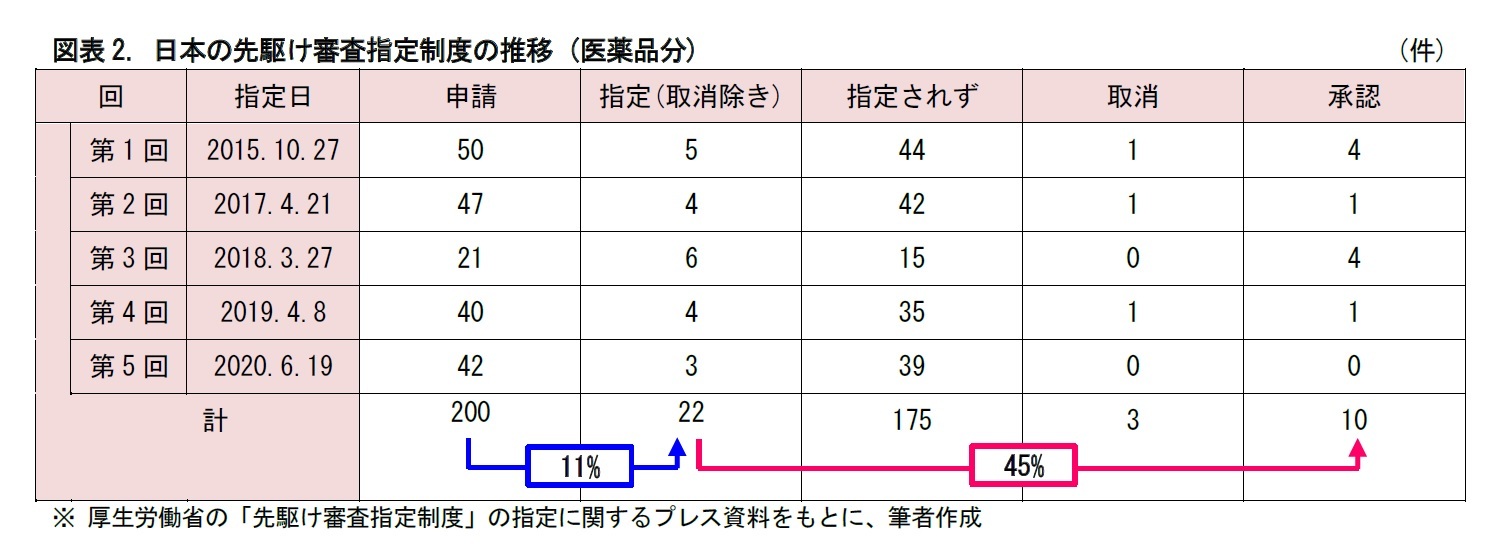
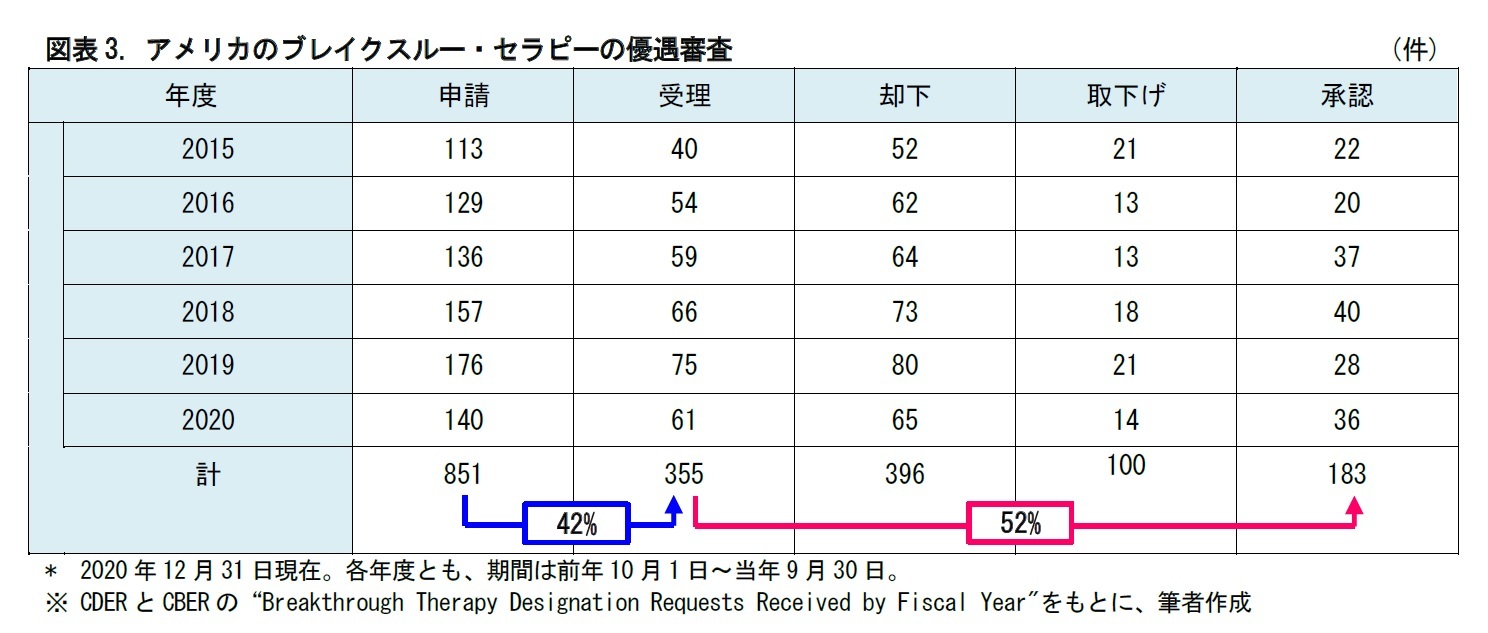
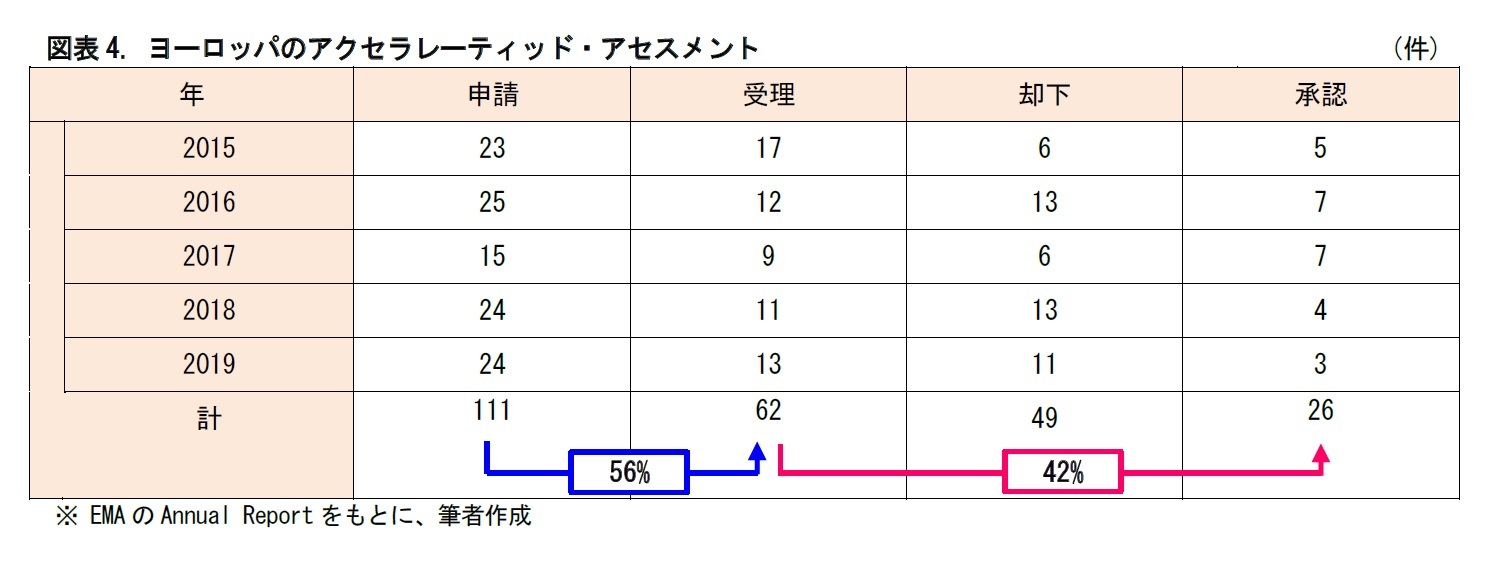
日米欧を比較すると、指定(受理)された後に承認に至る割合については、40~50%程度で大差はない。一方、申請が指定(受理)される割合については、日本の11%に対して、アメリカ42%、ヨーロッパ56%と、差がついている。
各制度の適用要件や内容が異なるため、単純な比較が困難な面はあるが、どうやら日本の制度は申請してもなかなか指定に至らないと言えそうだ。見方を変えれば、日本には、まだ優遇審査制度の活用余地が残されている、ともいえるだろう。
5――おわりに (私見)
新型コロナウイルスなどの感染症に限らず、生活習慣病、認知症など、さまざまな病気に対して、医薬品の開発は、医療技術高度化の大きな要素を占めるものとなっていくだろう。引き続き、医薬品の開発・流通や、基盤となる諸制度の動向を、注視していくこととしたい。
(2021年05月14日「基礎研レター」)

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員
篠原 拓也 (しのはら たくや)
研究・専門分野
保険商品・計理、共済計理人・コンサルティング業務
03-3512-1823
- 【職歴】
1992年 日本生命保険相互会社入社
2014年 ニッセイ基礎研究所へ
【加入団体等】
・日本アクチュアリー会 正会員
篠原 拓也のレポート
| 日付 | タイトル | 執筆者 | 媒体 |
|---|---|---|---|
| 2025/05/27 | 気候指数 2024年データへの更新-日本の気候の極端さは1971年以降の最高水準を大幅に更新 | 篠原 拓也 | 基礎研レポート |
| 2025/05/20 | 「次元の呪い」への対処-モデルの精度を上げるにはどうしたらよいか? | 篠原 拓也 | 研究員の眼 |
| 2025/05/13 | チェス盤を用いた伝心-愛情と計算力があれば心は通じる? | 篠原 拓也 | 研究員の眼 |
| 2025/05/09 | 国民負担率 24年度45.8%の見込み-高齢化を背景に、欧州諸国との差は徐々に縮小 | 篠原 拓也 | 基礎研マンスリー |
新着記事
-
2025年10月21日
今週のレポート・コラムまとめ【10/14-10/20発行分】 -
2025年10月20日
中国の不動産関連統計(25年9月)~販売は前年減が続く -
2025年10月20日
ブルーファイナンスの課題-気候変動より低い関心が普及を阻む -
2025年10月20日
家計消費の動向(単身世帯:~2025年8月)-外食抑制と娯楽維持、単身世帯でも「メリハリ消費」の傾向 -
2025年10月20日
縮小を続ける夫婦の年齢差-平均3歳差は「第二次世界大戦直後」という事実
レポート紹介
-
研究領域
-
経済
-
金融・為替
-
資産運用・資産形成
-
年金
-
社会保障制度
-
保険
-
不動産
-
経営・ビジネス
-
暮らし
-
ジェロントロジー(高齢社会総合研究)
-
医療・介護・健康・ヘルスケア
-
政策提言
-
-
注目テーマ・キーワード
-
統計・指標・重要イベント
-
媒体
- アクセスランキング
お知らせ
-
2025年07月01日
News Release
-
2025年06月06日
News Release
-
2025年04月02日
News Release
【先駆的医薬品の開発促進-世界に先駆ける革新的な医薬品づくりの下地は整備されたか?】【シンクタンク】ニッセイ基礎研究所は、保険・年金・社会保障、経済・金融・不動産、暮らし・高齢社会、経営・ビジネスなどの各専門領域の研究員を抱え、様々な情報提供を行っています。
先駆的医薬品の開発促進-世界に先駆ける革新的な医薬品づくりの下地は整備されたか?のレポート Topへ















 各種レポート配信をメールでお知らせ。読み逃しを防ぎます!
各種レポート配信をメールでお知らせ。読み逃しを防ぎます!




