- シンクタンクならニッセイ基礎研究所 >
- 社会保障制度 >
- 医療保険制度 >
- 治験の概要-臨床試験の現状 (前編)
治験の概要-臨床試験の現状 (前編)

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員 篠原 拓也
文字サイズ
- 小
- 中
- 大
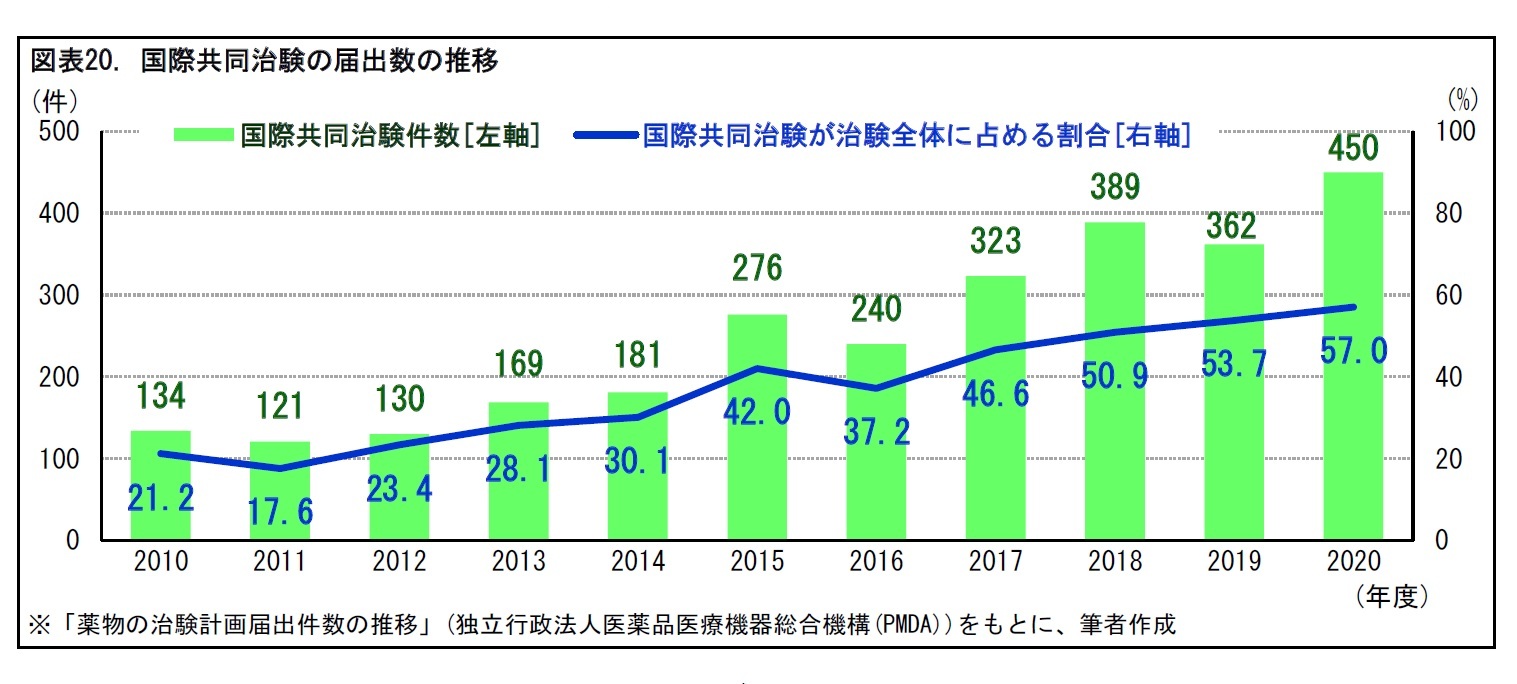
6――国際共同治験
1|第III相試験は、国際共同治験として行うことが一般的
通常、第III相試験は、数百人~数千人規模の患者を被験者として登録して行われる。もし承認を得ようとする国ごとに、これだけの数の被験者を確保して治験を進めようとすれば、多くの時間や費用がかかる。そこで、近年、第III相試験は、国際共同治験として行うことが一般的となっている。
この10年で、日本で届け出のあった国際共同治験の数は、大きく増加している。国際共同治験の2020年度の届出数は450件で、治験全体の57%を占めている。
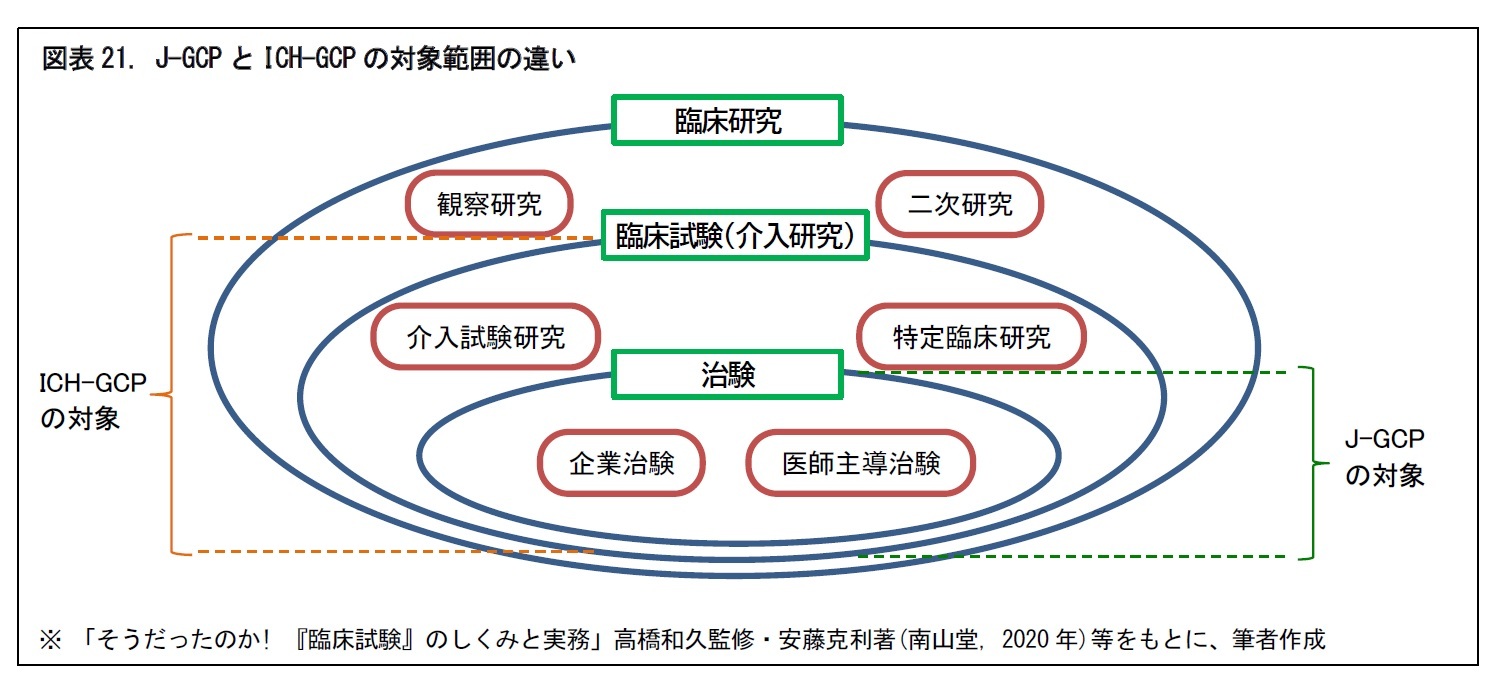
2|国際共同治験には日本の治験では対象外の臨床試験も含まれる
国際共同治験を行う際のルールは、国際的に定められている必要がある。医薬品規制調和国際会議(ICH20)が国際的に共有化したGCP(Good Clinical Practice (臨床試験の実施基準))がそのベースとなる。日本から国際共同治験に参加して、日本の承認申請にそのデータを用いる場合、GCP省令(J-GCP)とともに、ICHが定めたGCP(ICH-GCP)も遵守することが必要となる。
J-GCPとICH-GCPでは、対象となる臨床試験の範囲が異なっている。J-GCPの対象は、治験と製造販売後臨床試験のみであるのに対して、ICH-GCPは、承認申請を目的としない臨床試験も対象としている。
20 ICHは、International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human use の略。
7――おわりに
次稿(後編)では、治験の実務について概観していく。そして最後に、治験についてのまとめと私見を述べることとしたい。
【参考文献・資料】
(下記1~5の文献・資料は、包括的に参考にした)
- 「そうだったのか! 『臨床試験』のしくみと実務」高橋和久監修・安藤克利著(南山堂, 2020年)
- 「治験薬学(改訂第2版)-治験のプロセスとスタッフの役割と責任」亀井淳三・鈴木彰人編(南江堂, 2020年)
- 「医師主導治験START BOOK」内田英二編, 須崎友紀・川村芳江著(南山堂, 2016年)
- 「CRCのための治験業務マニュアル 第3版」亀山周二監修・CRCのための治験業務マニュアル作成委員会編(じほう, 2020年)
- 「徹底研究『治験』と『臨床』-運用の視点・患者の視点で読み解く」公益財団法人 医療科学研究所監修(法研, 2018年)
(下記の文献・資料は、内容の一部を参考にした)
- 「治験って何のこと?」(エン転職 「転職大辞典」)
https://employment.en-japan.com/tenshoku-daijiten/15017/ - 「治験管理室だより」(東京慈恵会医科大学附属第三病院 治療管理室, 2005年夏号)
- 「広辞苑 第七版」(岩波書店)
- 「薬物の治験計画届出件数の推移」(独立行政法人医薬品医療機器総合機構(PMDA))
- 「厚生労働白書(平成24年版)」(厚生労働省)
- 「「「医薬品の臨床試験の実施の基準に関する省令」のガイダンスについて」の改正について」(厚生労働省, 薬生薬審発0831第15号, 令和2年8月31日)
- “「ニュルンベルク綱領(翻訳)」(福岡臨床研究倫理審査委員会ネットワーク) https://www.med.kyushu-u.ac.jp/recnet_fukuoka/houki-rinri/nuremberg.html
- 「ヘルシンキ宣言-人間を対象とする医学研究の倫理的原則」(日本医師会訳)
https://www.med.or.jp/dl-med/wma/helsinki2013j.pdf
- 「本当にわかる 精神科の薬はじめの一歩 改訂版」稲田健編(羊土社, 2018年)
- 「『感染症予防ワクチンの臨床試験ガイドライン』について」(厚生労働省, 薬食審査発0527 第5号, 平成22年5月27 日)
- 「麻疹の現状と今後の麻疹対策について」(国立感染症研究所 感染症情報センター, 平成14 年10 月)
- 「医療関係者のためのワクチンガイドライン第2版」(一般社団法人日本環境感染学会, 環境感染誌Vol. 29 suppl. III, 2014年)
- 「今後の新型コロナワクチンの接種について」(第19回厚生科学審議会予防接種・ワクチン分科会, 資料1, 2021年2月15日)
- 「新型コロナワクチンの接種について」(第21回厚生科学審議会予防接種・ワクチン分科会, 資料1, 2021年5月21日)
(なお、下記2編の拙稿については、本稿執筆の基礎とした)
- 「医薬品・医療機器の現状(前編)-後発薬 (ジェネリック医薬品) への切り替えは、医療費削減の切り札となるのか? 」篠原拓也(ニッセイ基礎研究所 基礎研レポート, 2015年7月28日)
https://www.nli-research.co.jp/report/detail/id=42615?site=nli - 「医薬品・医療機器の現状(後編)-患者の残薬問題解消のために、かかりつけ薬局は何をすべきか?」篠原拓也(ニッセイ基礎研究所 基礎研レポート, 2015年8月3日)
https://www.nli-research.co.jp/report/detail/id=42630?site=nli
(2021年07月29日「基礎研レポート」)

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員
篠原 拓也 (しのはら たくや)
研究・専門分野
保険商品・計理、共済計理人・コンサルティング業務
03-3512-1823
- 【職歴】
1992年 日本生命保険相互会社入社
2014年 ニッセイ基礎研究所へ
【加入団体等】
・日本アクチュアリー会 正会員
篠原 拓也のレポート
| 日付 | タイトル | 執筆者 | 媒体 |
|---|---|---|---|
| 2025/05/27 | 気候指数 2024年データへの更新-日本の気候の極端さは1971年以降の最高水準を大幅に更新 | 篠原 拓也 | 基礎研レポート |
| 2025/05/20 | 「次元の呪い」への対処-モデルの精度を上げるにはどうしたらよいか? | 篠原 拓也 | 研究員の眼 |
| 2025/05/13 | チェス盤を用いた伝心-愛情と計算力があれば心は通じる? | 篠原 拓也 | 研究員の眼 |
| 2025/05/09 | 国民負担率 24年度45.8%の見込み-高齢化を背景に、欧州諸国との差は徐々に縮小 | 篠原 拓也 | 基礎研マンスリー |
新着記事
-
2025年10月24日
消費者物価(全国25年9月)-コアCPI上昇率は拡大したが、先行きは鈍化へ -
2025年10月24日
保険業界が注目する“やせ薬”?-GLP-1は死亡率改善効果をもたらすのか -
2025年10月23日
御社のブランドは澄んでますか?-ブランド透明性が生みだす信頼とサステナビリティ開示のあり方(1) -
2025年10月23日
EIOPAがソルベンシーIIのレビューに関する技術基準とガイドラインのセットの新たな協議を開始等 -
2025年10月23日
中国:25年7~9月期GDPの評価-秋風索莫の気配が漂う中国経済。内需の悪化により成長率は減速
レポート紹介
-
研究領域
-
経済
-
金融・為替
-
資産運用・資産形成
-
年金
-
社会保障制度
-
保険
-
不動産
-
経営・ビジネス
-
暮らし
-
ジェロントロジー(高齢社会総合研究)
-
医療・介護・健康・ヘルスケア
-
政策提言
-
-
注目テーマ・キーワード
-
統計・指標・重要イベント
-
媒体
- アクセスランキング
お知らせ
-
2025年07月01日
News Release
-
2025年06月06日
News Release
-
2025年04月02日
News Release
【治験の概要-臨床試験の現状 (前編)】【シンクタンク】ニッセイ基礎研究所は、保険・年金・社会保障、経済・金融・不動産、暮らし・高齢社会、経営・ビジネスなどの各専門領域の研究員を抱え、様々な情報提供を行っています。
治験の概要-臨床試験の現状 (前編)のレポート Topへ
















 各種レポート配信をメールでお知らせ。読み逃しを防ぎます!
各種レポート配信をメールでお知らせ。読み逃しを防ぎます!




