- シンクタンクならニッセイ基礎研究所 >
- 社会保障制度 >
- 医療保険制度 >
- 創薬の難しさ-世界で1年間に開発される医薬品の数はどれくらいか?
創薬の難しさ-世界で1年間に開発される医薬品の数はどれくらいか?

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員 篠原 拓也
文字サイズ
- 小
- 中
- 大
1――はじめに
しかし、医薬品の開発は、簡単ではない。医薬品メーカーは、多額の研究開発費を投じて創薬に取り組んでいるものの、その成功が保証されているわけではない。多くの研究員や医療関係者が、医薬品候補のさまざまな化合物を相手に、物性や薬理などの研究や、臨床試験を重ねている。にもかかわらず、医薬品として世に出るのは、こうした化合物のうちのほんの一握りである。
なぜ、創薬は難しいのだろうか。本稿では、その理由について、みていくこととしたい。2
1 2014年に小野薬品工業社とブリストル・マイヤーズ スクイブ社が発売した、免疫チェックポイント阻害剤。
2 本稿の執筆にあたり、「創薬科学入門(改訂2版) -薬はどのようにつくられる?-」佐藤健太郎著(オーム社, 2018年)を参考にしている。
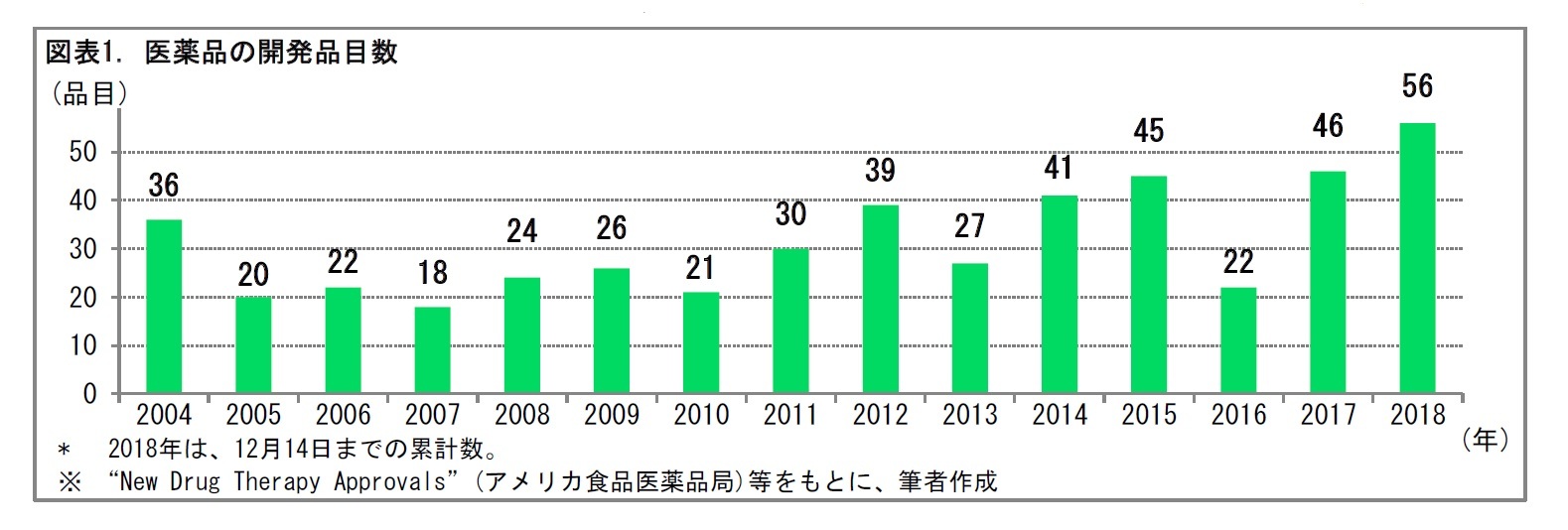
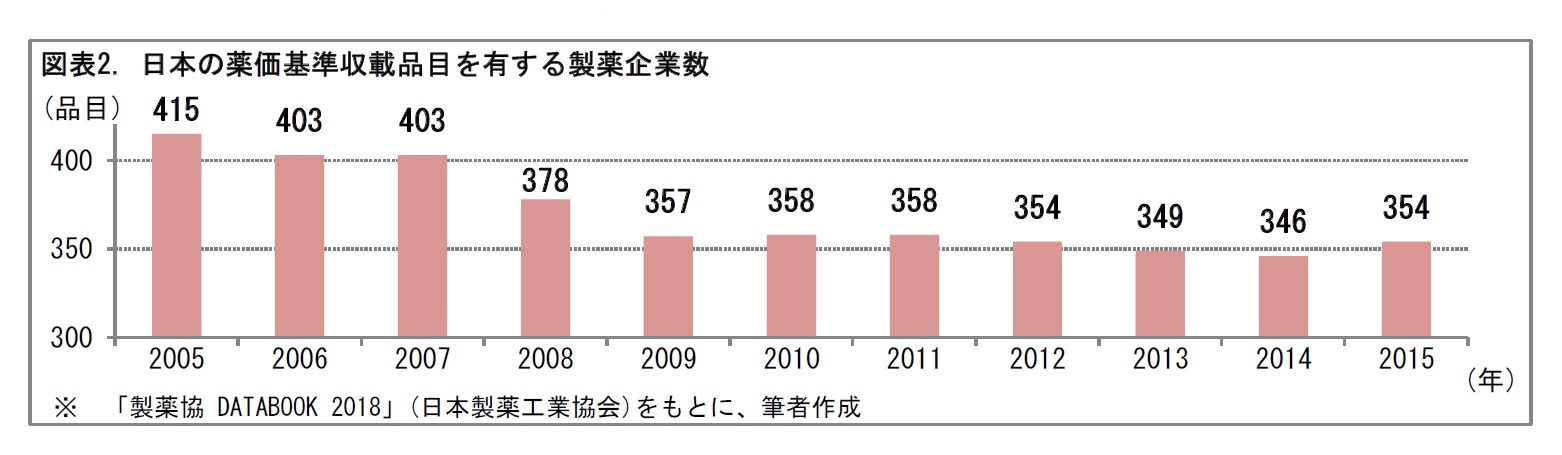
2――新薬と製薬企業の数
3――医薬品とタンパク質
ここでいう結合とは、化合物である医薬品と、体内のタンパク質の間で起こる、分子内結合や分子間結合、すなわち化学結合を指す。具体的には、原子や分子が結合したり離れたりする可逆的な結合として、水素結合、イオン結合、ファンデルワールス力などの弱い力の結合が中心となる3。
3 強い力の結合である共有結合は、酵素を完全に破壊する(不可逆阻害)などの弊害が出る恐れがあるため、通常、医薬品には用いられない。ただし、抗生物質や抗がん剤では、こうした不可逆阻害が用いられる場合もある。
4――医薬品の条件の厳しさ
1|医薬品は体内で運搬されるために水溶性が必要
医薬品は、患部に到達する必要がある。体内の主要成分は水であるため、投与された医薬品は、ある程度水に溶けて、体内で運搬されなくてはならない。すなわち、医薬品には水溶性が求められる。
2|経口投与される医薬品は胃酸や各種消化酵素による分解に耐えなくてはならない
医薬品の投与の仕方には、経口投与、経皮投与、注射(点滴を含む)など、いくつかの方法がある。このうち、患者のQOL(Quality of Life, 生活の質)を維持する観点からは、経口投与が望ましいとされる。患者が、日常生活の中で自ら服用できるため、手間や時間の点で有用性が高いからである。
経口投与の場合、医薬品は、胃や小腸で、胃酸や各種消化酵素による分解に耐えなくてはならない。一般に、生理活性を持つペプチド4やタンパク質は、消化酵素の分解を受けやすい。たとえば、抗がん薬やリウマチ薬として用いられる抗体医薬5は、タンパク質でできた医薬品である。このため、経口投与しても胃や小腸で分解されてしまう。そこで、抗体医薬は注射による投与が必要となる。
4 片方のアミノ酸のカルボキシル基(-COOH)と、もう片方のアミノ酸のアミノ基(-NH2)が1分子の水を除いて脱水縮合してできた結合(-CO-NH-)をペプチド結合という。このペプチド結合によって2つ以上のアミノ酸が結合した化合物をペプチドという。タンパク質は多数のアミノ酸からなるポリペプチドであるが、ペプチドがすべてタンパク質というわけではない。
5 人間がもともと持っている免疫機構を生かして、病気の原因である物質(抗原)に対する抗体をつくって体内に入れることで、予防や治療を行うもの。なお、抗体医薬は分子量が15万程度あるため、分子の大きさの点から細胞内に入ることは難しい。
消化管から吸収された医薬品は、血管内に入る。点滴で投与された医薬品も、直接、血管内に入る。通常、これらの医薬品は、門脈という静脈を通って肝臓に向かう。そして、肝臓で代謝を受けた後、再び血流に乗って患部に向かう。
肝臓では、門脈を介して解毒や、糖質の貯蔵が行われる。肝臓には、さまざまな代謝酵素があり、異物とみなされた化合物は、代謝・分解が進められる。医薬品は、肝臓で代謝・分解されると、老廃物や毒素などとともに腎臓に送られて排泄されてしまうため、患部にたどり着けない。そのため、肝臓であまり代謝を受けない化合物であることが必要となる。
4|細胞内に入って細胞内受容体に結合する医薬品は、細胞膜を通過しなくてはならない
医薬品がターゲットのタンパク質と結合するのは、患部の細胞近辺である。医薬品には、細胞外で細胞膜の受容体(タンパク質)と結合するものと、細胞内に入り込んで細胞内受容体に結合するものがある。ここでは、細胞内に入り込む医薬品について考えてみよう。
細胞膜は、脂質成分でできている。このため、細胞膜を通過して細胞内に入るためには、脂溶性を持つほうが有利となる。しかし、脂溶性を高め過ぎると、タンパク質との結合が阻害されて、医薬品としての効果が減じてしまう。このため、適度な脂溶性が求められることとなる。
また、細胞膜の通過については、医薬品の分子の大きさ(分子量)の問題もある。分子量が大きい医薬品は、細胞内に入り込むことが難しい。通常、細胞内に入るには、分子量500以下の化合物であることが必要とされる。一方で、医薬品が結合するタンパク質の大きさは、分子量が数万程度のものが一般的である。つまり、細胞内に入った医薬品は、自分よりも100倍くらい大きなタンパク質に結合して、その働きを制御することが求められる。
5|脳神経中枢に作用する医薬品は、血液脳関門を通過しなくてはならない
精神疾患などに対して脳神経中枢に作用する医薬品については、さらに大きなハードルが存在する。脳の中の血管には、「血液脳関門」という血液中の異物を遮断するバリアがある。これは、血管の内側を覆う血管内皮細胞で構成されている。医薬品は、このバリアをくぐり抜けないと、脳神経中枢に作用できない。このため、分子量が小さく、脂溶性が高い化学構造の化合物であることが必要となる。
6|医薬品は、ターゲットのタンパク質に正しく結合しなくてはならない
体内のタンパク質の種類は多い。中には、構造がよく似たものどうしもある。医薬品がターゲットとするタンパク質によく似た、別のタンパク質があると、医薬品がその別のタンパク質と結合してしまう恐れがある。医薬品は、ターゲットのタンパク質に正しく結合する必要がある。
7|医薬品は、血液内で一定の濃度で安定的にとどまることが必要
医薬品は、一定の時間が経つと、分解、排泄される。薬効が生じる前に分解されてしまったり、逆に排泄されずに体内に蓄積されてしまったりすると、医薬品本来の役割を果たすことができない。
また、わずかではあるが医薬品はそれ自体毒性を持つことが一般的とされる。このため、医薬品の血中濃度を高めようとして投与量を多くすると、毒性が高まったり、副作用が出たりすることもある。
医薬品が薬効を示すためには、一定時間、安定した濃度で血液中にとどまることが条件となる。
8|複数の医薬品を投与すると、相互作用が生じることがある
複数の医薬品を投与する場合には、さらに注意が必要となる。医薬品どうしで、相互作用が生じることがあるためである。相互作用には、「薬物動態学的相互作用」と「薬力学的相互作用」がある。
6 NSAIDsは、Non-Steroidal Anti-Inflammatory Drugsの略。
7 創薬においては、医薬品の品質確保のために、GMP(Good Manufacturing Practice)と呼ばれるルールが厚生労働省の省令で定められている。創薬の各段階で、このルールを遵守しなくてはならない。また医薬品については、この他にも、前臨床段階の各種試験手順、臨床試験の規定、発売後の品質管理などのルールが定められている。
(2018年12月17日「基礎研レター」)

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員
篠原 拓也 (しのはら たくや)
研究・専門分野
保険商品・計理、共済計理人・コンサルティング業務
03-3512-1823
- 【職歴】
1992年 日本生命保険相互会社入社
2014年 ニッセイ基礎研究所へ
【加入団体等】
・日本アクチュアリー会 正会員
篠原 拓也のレポート
| 日付 | タイトル | 執筆者 | 媒体 |
|---|---|---|---|
| 2025/05/27 | 気候指数 2024年データへの更新-日本の気候の極端さは1971年以降の最高水準を大幅に更新 | 篠原 拓也 | 基礎研レポート |
| 2025/05/20 | 「次元の呪い」への対処-モデルの精度を上げるにはどうしたらよいか? | 篠原 拓也 | 研究員の眼 |
| 2025/05/13 | チェス盤を用いた伝心-愛情と計算力があれば心は通じる? | 篠原 拓也 | 研究員の眼 |
| 2025/05/09 | 国民負担率 24年度45.8%の見込み-高齢化を背景に、欧州諸国との差は徐々に縮小 | 篠原 拓也 | 基礎研マンスリー |
新着記事
-
2025年10月22日
高市新政権が発足、円相場の行方を考える~マーケット・カルテ11月号 -
2025年10月22日
貿易統計25年9月-米国向け自動車輸出が数量ベースで一段と落ち込む。7-9月期の外需寄与度は前期比▲0.4%程度のマイナスに -
2025年10月22日
米連邦地裁、Googleへの是正措置を公表~一般検索サービス市場における独占排除 -
2025年10月21日
選択と責任──消費社会の二重構造(2)-欲望について考える(3) -
2025年10月21日
連立協議から選挙のあり方を思う-選挙と同時に大規模な公的世論調査の実施を
レポート紹介
-
研究領域
-
経済
-
金融・為替
-
資産運用・資産形成
-
年金
-
社会保障制度
-
保険
-
不動産
-
経営・ビジネス
-
暮らし
-
ジェロントロジー(高齢社会総合研究)
-
医療・介護・健康・ヘルスケア
-
政策提言
-
-
注目テーマ・キーワード
-
統計・指標・重要イベント
-
媒体
- アクセスランキング
お知らせ
-
2025年07月01日
News Release
-
2025年06月06日
News Release
-
2025年04月02日
News Release
【創薬の難しさ-世界で1年間に開発される医薬品の数はどれくらいか?】【シンクタンク】ニッセイ基礎研究所は、保険・年金・社会保障、経済・金融・不動産、暮らし・高齢社会、経営・ビジネスなどの各専門領域の研究員を抱え、様々な情報提供を行っています。
創薬の難しさ-世界で1年間に開発される医薬品の数はどれくらいか?のレポート Topへ
















 各種レポート配信をメールでお知らせ。読み逃しを防ぎます!
各種レポート配信をメールでお知らせ。読み逃しを防ぎます!




