- シンクタンクならニッセイ基礎研究所 >
- 社会保障制度 >
- 医療保険制度 >
- 医薬品・医療機器の現状 2015年度総まとめ
医薬品・医療機器の現状 2015年度総まとめ

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員 篠原 拓也
文字サイズ
- 小
- 中
- 大
ここで、医療・介護制度の関係者を洗い出してみよう。
まず、保険料を支払う一般国民が居り、その中に、サービスを受ける患者・要介護者が居る。サービスを提供する側では、医療機関や介護福祉施設の中で、医師・看護師・福祉施設介護員等が活躍し、在宅医療・在宅ケアでは、居宅を訪問する医師・看護師・ホームヘルパー等が活躍している。国民健康保険等の公的保険制度を運営する保険者も役割を果たしている。そして、制度の安定運営のために各機関を監督する役割を担う政府・地方自治体が挙げられる。医療・介護の問題を考える場合には、これらの関係者を中心に検討していくことが一般的と言える。
しかしながら、医薬品・医療機器に関する問題を考える場合には、これらの関係者だけでは不十分である。まず、医薬品・医療機器を開発・販売する医薬品・医療機器メーカーを考えなくてはならない。また、医師の処方箋に基づいて患者に医薬品等を処方する薬剤師を抱える保険薬局の存在も欠かせない。更に、医薬品・医療機器メーカーと医療機関・保険薬局の間で、円滑に医薬品等を流通させる医薬品卸の存在も重要である。このように、医薬品・医療機器に関する問題を考える場合には、関係者の範囲が広くなる点に留意が必要となる。このため、関係者間の利害関係が複雑となり、ある問題の解決のために多くの時間を要する場合や、大幅な制度変更が必要な場合が生じる。
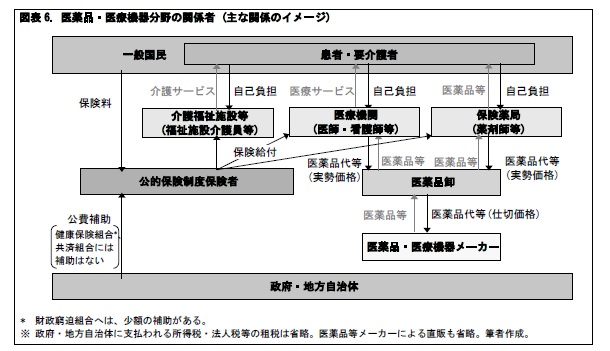
後発薬への置き換え問題は、その一例と言える。後発薬は新薬に比べて価格が安いため、医療費の削減につながる。これは、患者の自己負担を減らすとともに、政府等からの公費の抑制や国民の保険料負担の軽減にもつながる。一方、医療機関や保険薬局にとっては、診療報酬・調剤報酬や、後発薬に置き換えた場合の保険償還価格(保険給付の基準となる公定価格)と実勢価格(医薬品卸からの仕入価格)の差に関心が向く。これらが増加するのであれば、置き換えに前向きとなる。医薬品卸にとっては、実勢価格(医療機関・保険薬局への販売価格)と仕切価格(医薬品・医療機器メーカーからの仕入価格)の差が儲けとなるため、その増減に関心が集まる。医薬品・医療機器メーカーにとっては、仕切価格(医薬品卸への販売価格)と製造原価の差が儲けであり、その確保に向けて製造・販売を進めることとなる。このように、医薬品・医療機器メーカーや医薬品卸にとって、公的医療制度の医療費の削減と、自社収益の拡大は別の問題と映る。従って、後発薬への置き換えを促すためには、医薬品・医療機器メーカーや医薬品卸に後発薬を製造・流通させるためのインセンティブの導入が必要となる。
3|医薬品・医療機器の分類
一口に、医薬品や医療機器と言っても、その範囲は幅広い。法令が規制の対象としている医薬品や医療機器の範囲も多種多様である。2014年に薬事法が薬機法に改正8された。法改正は、薬害肝炎事件を発端に検討が始まり、安全対策の強化が主目的とされた。具体的には、医療用医薬品、要指導医薬品、医療機器、再生医療等製品の製造販売時には、警告、禁忌、使用上の注意(副作用、高齢者への投与、過量投与等を含む。)、取扱い上の注意などを記載した「添付文書」をあらかじめ作成し、医薬品医療機器総合機構(PMDA9)に届け出ることが義務化された。併せて、医療機器について第三者機関による認証対象を拡大するなど、特性を踏まえた規制の整備がなされた。更に、再生医療等製品について定義規定を設けた上で、条件・期限付承認制度が導入された。これにより、法令の規制対象は、従来の医薬品、医療機器、医薬部外品、化粧品に、再生医療等製品が加えられて、5種類に拡大された。
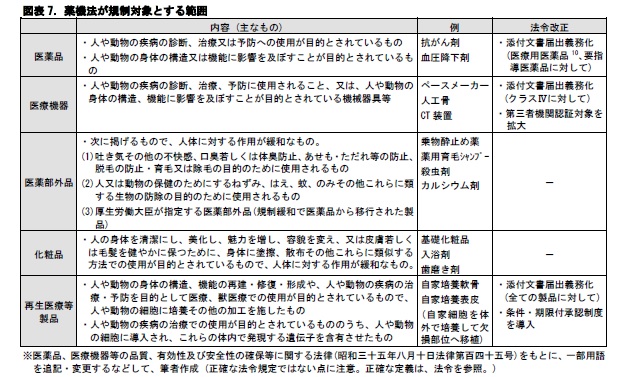
このうち、医薬品は、リスクの大きさに応じて、薬局医薬品、要指導医薬品、一般用医薬品に区分される。薬局医薬品は、医療用医薬品と薬局製剤に分けられる。それぞれの区分別に、患者への積極的な情報提供、販売者、ネット販売の可否などの取り扱いルールが定められている。
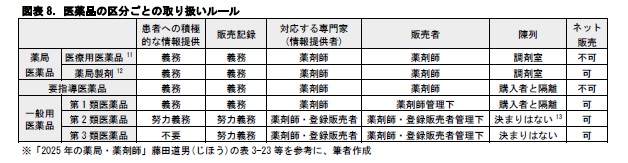
同様に、医療機器についても、不具合が生じた場合のリスクの大きさに応じて、国際分類14で、クラスⅠ~Ⅳの区分がなされており、それぞれの区分別に、承認・認証の規制が異なっている。

8 薬機法の正式名称は、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」で「医薬品医療機器等法」と略されることもある。法改正に伴う実務変更の詳細は、「医薬品医療機器等法の施行に向けて -添付文書の作成・改訂と届出 他-」山本剛(厚生労働省医薬食品局安全対策課)に記述されている。
9 PMDAは、Pharmaceuticals and Medical Devices Agencyの略。厚生労働省所管の独立行政法人。法律上、医薬品の副作用又は生物由来製品を介した感染等による健康被害の迅速な救済を図り、並びに医薬品等の品質、有効性及び安全性の向上に資する審査等の業務を行い、もって国民保健の向上に資することを目的とする、とされている。2004年に発足。
10 ただし、体外診断用医薬品、承認不要医薬品は、届出義務の対象外。
11 薬歴管理等所定の条件を満たせば、医師の処方箋がなくても販売可能なものもある。「処方箋医薬品以外の医療用医薬品」と言われ、経口投与のビタミン剤、漢方薬、抗アレルギー剤などがこれに該当する。医療用医薬品の1/3程度を占める。
12 正式には、薬局製造販売医薬品。
13 第2類医薬品のうち、指定第2類医薬品は情報提供カウンターなどより7メートル以内に陳列することとされている。
14 日本、アメリカ、ヨーロッパ、オーストラリア、カナダが参加する医療機器規制国際整合化会議(Global Harmonization Task Force, GHTF)において、2003年に合意された分類の考え方が、薬機法の中に採り入れられている。
(2016年06月28日「ニッセイ基礎研所報」)

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員
篠原 拓也 (しのはら たくや)
研究・専門分野
保険商品・計理、共済計理人・コンサルティング業務
03-3512-1823
- 【職歴】
1992年 日本生命保険相互会社入社
2014年 ニッセイ基礎研究所へ
【加入団体等】
・日本アクチュアリー会 正会員
篠原 拓也のレポート
| 日付 | タイトル | 執筆者 | 媒体 |
|---|---|---|---|
| 2025/05/27 | 気候指数 2024年データへの更新-日本の気候の極端さは1971年以降の最高水準を大幅に更新 | 篠原 拓也 | 基礎研レポート |
| 2025/05/20 | 「次元の呪い」への対処-モデルの精度を上げるにはどうしたらよいか? | 篠原 拓也 | 研究員の眼 |
| 2025/05/13 | チェス盤を用いた伝心-愛情と計算力があれば心は通じる? | 篠原 拓也 | 研究員の眼 |
| 2025/05/09 | 国民負担率 24年度45.8%の見込み-高齢化を背景に、欧州諸国との差は徐々に縮小 | 篠原 拓也 | 基礎研マンスリー |
新着記事
-
2025年10月16日
EIOPAが2026年のワークプログラムと戦略的監督上の優先事項を公表-テーマ毎の活動計画等が明らかに- -
2025年10月16日
再び不安定化し始めた米中摩擦-経緯の振り返りと今後想定されるシナリオ -
2025年10月15日
インド消費者物価(25年10月)~9月のCPI上昇率は1.5%に低下、8年ぶりの低水準に -
2025年10月15日
「生活の質」と住宅価格の関係~教育サービス・治安・医療サービスが新築マンション価格に及ぼす影響~ -
2025年10月15日
IMF世界経済見通し-世界成長率見通しは3.2%まで上方修正
レポート紹介
-
研究領域
-
経済
-
金融・為替
-
資産運用・資産形成
-
年金
-
社会保障制度
-
保険
-
不動産
-
経営・ビジネス
-
暮らし
-
ジェロントロジー(高齢社会総合研究)
-
医療・介護・健康・ヘルスケア
-
政策提言
-
-
注目テーマ・キーワード
-
統計・指標・重要イベント
-
媒体
- アクセスランキング
お知らせ
-
2025年07月01日
News Release
-
2025年06月06日
News Release
-
2025年04月02日
News Release
【医薬品・医療機器の現状 2015年度総まとめ】【シンクタンク】ニッセイ基礎研究所は、保険・年金・社会保障、経済・金融・不動産、暮らし・高齢社会、経営・ビジネスなどの各専門領域の研究員を抱え、様々な情報提供を行っています。
医薬品・医療機器の現状 2015年度総まとめのレポート Topへ















 各種レポート配信をメールでお知らせ。読み逃しを防ぎます!
各種レポート配信をメールでお知らせ。読み逃しを防ぎます!




