- シンクタンクならニッセイ基礎研究所 >
- 社会保障制度 >
- 医療保険制度 >
- 医薬品添付文書のルール変更-安全性を高めるために、添付文書のどこを見るべきか?
医薬品添付文書のルール変更-安全性を高めるために、添付文書のどこを見るべきか?

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員 篠原 拓也
文字サイズ
- 小
- 中
- 大
1――はじめに
医薬品を投与・処方するにあたっては、警告、禁忌、医薬品の組成・性状、効能・効果、相互作用、副作用など、さまざまな情報が必要となる。それらをまとめて、「医薬品添付文書」(以下、「添付文書」)が作成されている。添付文書は、医薬品に添付されるとともに、一般向けにも公表されている。
今般、添付文書の記載要領が改正され、2019年4月から新たなルールでの運用が開始されている1。本稿では、添付文書のうち、安全性に関わる警告や禁忌などの表示についてみていくこととしたい。2
1 2019年4月~2024年3年までの5年間は経過措置期間とされており、記載要領改正前後の添付文書が併存することとなる。
2 本稿執筆にあたり、「薬をもっと使いこなすための添付文書の読み方・活かし方」野村香織(じほう, 2018年)、「薬剤師のための添付文書活用ハンドブック 改訂版」山村重雄(日経メディカル開発, 2015年)を参考にしている。
2――添付文書とは
3 法律名は「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」。
添付文書には、医師・歯科医師・薬剤師等の医療関係者が、患者に投与・処方するときに注意すべき情報などが記載されている。ただし、閲覧が医療関係者のみに限られているわけではない。独立行政法人医薬品医療機器総合機構(PMDA)のホームページで検索することにより、誰でも添付文書を見ることができる4。患者や家族が、処方された医薬品の添付文書を見ることも、可能となっている。
4 独立行政法人医薬品医療機器総合機構のホームページ(https://www.pmda.go.jp/)における「添付文書等検索」で、「医療用医薬品」、「医療機器」、「一般用・要指導医薬品」、「体外診断用医薬品」のいずれかを選び、医薬品の名称(一般名・販売名)等を入力することで閲覧できる。なお、PMDAは、Pharmaceuticals and Medical Devices Agencyの略。
添付文書の記載事項と記載方法の大枠は、記載要領で定められている。しかし、記載方法の詳細や、記載内容が統一されているわけではない。これらは、各医薬品メーカーに委ねられている。このため、記載内容がまちまちとなり、医療関係者の一部からは情報が読み取りにくい、との声があがっている。
4|添付文書は何度も改訂されることが一般的
医薬品メーカーはPMDAに医薬品の承認や効能追加を申請する際に、添付文書案を作成して申請書類の1つとして提出する。その後、PMDAからの指摘による修正を経て、厚生労働省での審査に付される。具体的には、薬事・食品衛生審議会の医薬品第一部会・第二部会5にて、承認の可否が審議される。通常、添付文書の内容について部会で指摘が行なわれた場合は、添付文書の修正等が行われる。
医薬品は市販後にも、いくつかの理由で改訂されることがある。副作用の報告の集積や、再審査、再評価の結果の表示などである。このため、医薬品に実際に添付されている添付文書ではなく、最新の添付文書(PMDAのホームページで閲覧可能)が有効とされる。
5 2つの部会のうち、第二部会では、抗菌薬、化学療法薬、抗悪性腫瘍薬、血液製剤、生物学的製剤を審議する。第一部会では、第二部会の審議対象以外の薬効群を審議する。なお、それぞれの部会とも、年8回程度開催される。
3――識別番号・日付・管理上の注意
さらに、医薬品の管理上の注意も大切である。医薬品は、保存方法を誤ると、各種の成分が化学的に変化することがある。場合によっては、有効成分が弱まり、品質が低下することもある。一部の医薬品に対しては、厚生労働省の告示で、包装容器などへの使用期限の記載が義務づけられている6。
医薬品の投与・処方を安全に行なうために、まず、処方対象の医薬品の添付文書を明確にして、その医薬品の適切な保存管理について表示することとされている。
6 「薬事法第50条第12号等の規定に基づき使用の期限を記載しなければならない医薬品等」(昭和55年9月26日厚生省告示第166号)に、「アスピリン及びその製剤」、「インシュリン及びその製剤」など49の医薬品が指定されている。
4――添付文書の記載項目
7 本章の内容は、「医療用医薬品の添付文書等の記載要領について」(厚生労働省医薬・生活衛生局長通知, 薬生発0608第1号, 平成29年6月8日)と、「医療用医薬品の添付文書等の記載要領の留意事項について」(厚生労働省医薬・生活衛生局安全対策課長通知, 薬生安発0608第1号, 平成29年6月8日)をもとにしている。
(1) 警告
警告は、致死的又は極めて重篤かつ非可逆的な副作用が発現する場合、又は副作用が発現する結果極めて重大な事故につながる可能性があって、特に注意を喚起する必要がある場合に記載される。
そもそも添付文書の大きな目的は、医薬品を患者等に安全に投与・処方することといえる。そこで特に、警告は赤字・赤枠・ゴシック体で目立つように、記載することとされている。また、警告が記載されている場合、白色紙の右上縁に赤色の帯を印刷して目立たせることとされている。(赤色の帯のイメージは、本稿PDFファイルの3ページをご参照いただきたい。) これは、書類の左側をバインダー等に綴じた場合に、右側の赤色の帯により、当該ページが目立つことを狙ったものと考えられる8。
8 なお、このような工夫は、日本独特の書式とみられる。
9 ただし内容によっては、「効能又は効果に関連する注意」、「用法及び用量に関連する注意」、「相互作用」の項目に記載される場合もある。
10 「特定の背景を有する患者に関する注意」には、高齢者、妊婦、授乳婦、小児等に対する投与がそれぞれ細目として設けられた。このため、記載要領改正前の「高齢者への投与」、「妊婦、産婦、授乳婦等への投与」、「小児等への投与」の項目もこれらに集約されることとなり、廃止された。
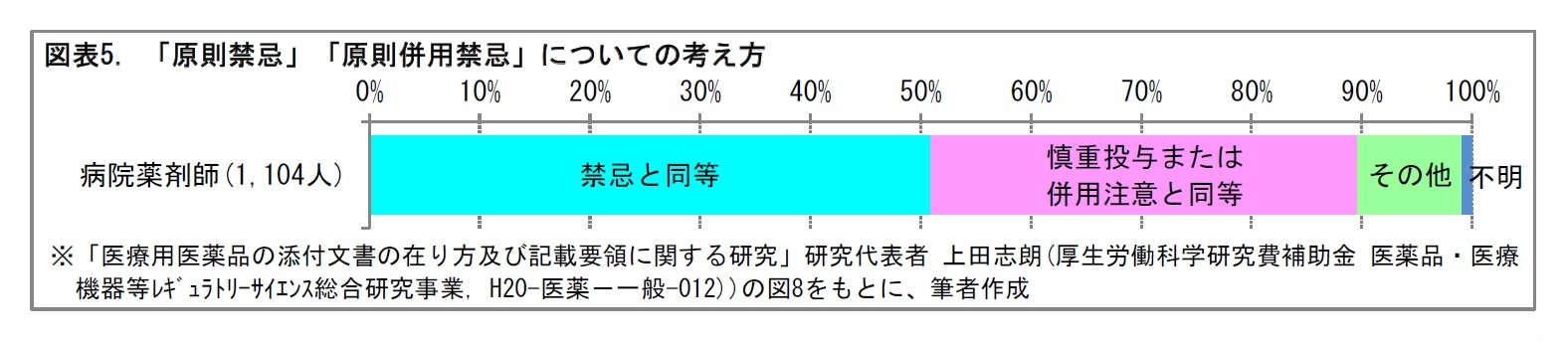
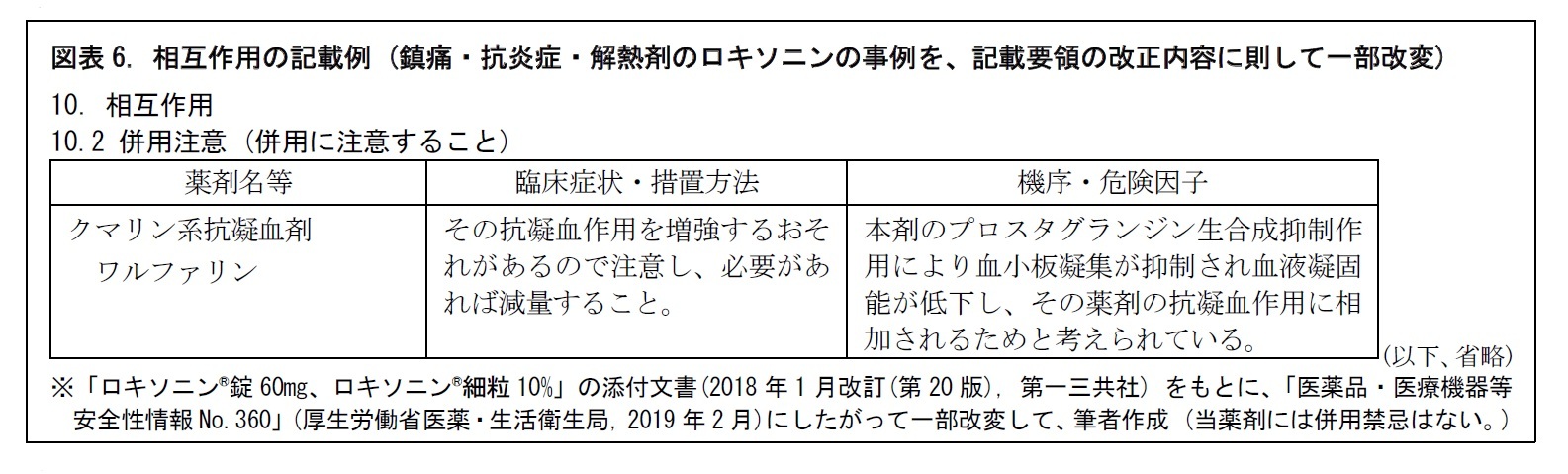
医薬品の安全性をみる上で、相互作用の問題は欠かせない。医薬品を他の医薬品と併用することにより、その医薬品または併用した医薬品の薬理作用が増強したり減弱したりする。副作用が増強したり、新たな副作用が出現したり、原疾患が増悪することもある。「相互作用」には、こうした臨床上注意を要する組合せを記載する。また、医薬品以外で、物理療法や飲食物などとの相互作用についても、重要なものは記載する。具体的には、併用禁忌と併用注意に分けて、表形式で、記載される。
一般に、相互作用には「薬物動態学的相互作用」と「薬力学的相互作用」がある11。ただし、相互作用を完全に解明することは困難である。未解明の場合は、「機序不明」などと記載されることもある。
11 「薬物動態学的相互作用」は、薬物の代謝や排泄を阻害したり促進したりすることにより、薬物の血中濃度が上昇したり低下したりすることを指す。「薬力学的相互作用」は、神経伝達物質の受容体などへの作用が、薬物どうしで競合したり阻害したりすることを指す。
副作用の問題は、医薬品の投与・処方において切っても切れない。このため、副作用の情報は重視される。副作用は、「重大な副作用」と「その他の副作用」の2つに分けて記載される12。
このうち、重大な副作用には、副作用の転帰13や重篤性を考慮し、「特に注意を要するもの」が記載される。具体的には、副作用の事象名を項目として、初期症状(臨床検査値の異常)、発現機序、発生までの期間、リスク要因、防止策、特別な処置方法等が判明している場合には、必要に応じて記載される。また、海外のみで知られている重大な副作用についても、必要に応じて記載される。なお、類薬で知られている重大な副作用については、同様の注意が必要と考えられる場合に限り記載される。
添付文書の副作用の記載内容には、厚生労働省の通知や事務連絡に基づく改訂や、医薬品メーカーの自主改訂が行なわれる。これは、新薬開発時の臨床試験ではあらわれていなかった副作用が、市販後に判明することなどによって追加されるためである16,17。
12 記載要領改正前は、「副作用等発現状況の概要」も記載することとされていた。
13 病気の経過のゆきつくところ。(「広辞苑 第七版」(岩波書店)より)
14 ICHは、International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Useの略。
15 医薬品医療機器等法施行規則の第228条の20 (副作用等報告)で、医薬品の製造販売業者等は(1)~(6)の事項を知ったときは15日以内に報告することとされている。
16 2001年には、市販直後調査が導入された。これは新薬販売開始から6ヵ月間行われる調査で、重篤な副作用や感染症の情報を迅速に収集し、必要な対策を実施し、副作用や感染症の被害を最小限にすることを目的としている。
17 副作用の記載内容は、添付文書により大きく異なる。なかには、頻度表示がないもの。頻度表示はあっても比率の分母と分子が不明なもの。初期症状や対処法の記載がないものもある。医療関係者からは、改善すべきとの声があがっている。
5――おわりに (私見)
一方、近年、抗がん剤などで画期的な医薬品が登場しつつあり、治療における医薬品の重要度は高まっているものとみられる。このため、患者やその家族が、処方された医薬品の添付文書に関心を持つことが望ましいと考えられる。添付文書に、わかりやすい表現で安全性や有効性を表示する必要性が高まるものとみられる。今後も引き続き、医薬品メーカーの動向に注視していくこととしたい。
(2019年04月12日「基礎研レター」)

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員
篠原 拓也 (しのはら たくや)
研究・専門分野
保険商品・計理、共済計理人・コンサルティング業務
03-3512-1823
- 【職歴】
1992年 日本生命保険相互会社入社
2014年 ニッセイ基礎研究所へ
【加入団体等】
・日本アクチュアリー会 正会員
篠原 拓也のレポート
| 日付 | タイトル | 執筆者 | 媒体 |
|---|---|---|---|
| 2025/05/27 | 気候指数 2024年データへの更新-日本の気候の極端さは1971年以降の最高水準を大幅に更新 | 篠原 拓也 | 基礎研レポート |
| 2025/05/20 | 「次元の呪い」への対処-モデルの精度を上げるにはどうしたらよいか? | 篠原 拓也 | 研究員の眼 |
| 2025/05/13 | チェス盤を用いた伝心-愛情と計算力があれば心は通じる? | 篠原 拓也 | 研究員の眼 |
| 2025/05/09 | 国民負担率 24年度45.8%の見込み-高齢化を背景に、欧州諸国との差は徐々に縮小 | 篠原 拓也 | 基礎研マンスリー |
新着記事
-
2025年09月16日
今週のレポート・コラムまとめ【9/9-9/12発行分】 -
2025年09月12日
ECB政策理事会-2会合連続で全会一致の据え置き決定 -
2025年09月12日
欧州経済見通し-関税合意後も不確実性が残る状況は続く -
2025年09月12日
「イマーシブ」の消費文化論-今日もまたエンタメの話でも。(第7話) -
2025年09月12日
グローバル株式市場動向(2025年8月)-米国の利下げ期待から堅調な推移
レポート紹介
-
研究領域
-
経済
-
金融・為替
-
資産運用・資産形成
-
年金
-
社会保障制度
-
保険
-
不動産
-
経営・ビジネス
-
暮らし
-
ジェロントロジー(高齢社会総合研究)
-
医療・介護・健康・ヘルスケア
-
政策提言
-
-
注目テーマ・キーワード
-
統計・指標・重要イベント
-
媒体
- アクセスランキング
お知らせ
-
2025年07月01日
News Release
-
2025年06月06日
News Release
-
2025年04月02日
News Release
【医薬品添付文書のルール変更-安全性を高めるために、添付文書のどこを見るべきか?】【シンクタンク】ニッセイ基礎研究所は、保険・年金・社会保障、経済・金融・不動産、暮らし・高齢社会、経営・ビジネスなどの各専門領域の研究員を抱え、様々な情報提供を行っています。
医薬品添付文書のルール変更-安全性を高めるために、添付文書のどこを見るべきか?のレポート Topへ




















 各種レポート配信をメールでお知らせ。読み逃しを防ぎます!
各種レポート配信をメールでお知らせ。読み逃しを防ぎます!




