- シンクタンクならニッセイ基礎研究所 >
- 社会保障制度 >
- 医療保険制度 >
- バイオシミラーの普及-薬剤費抑制のためには、どういう取り組みが必要か?
バイオシミラーの普及-薬剤費抑制のためには、どういう取り組みが必要か?

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員 篠原 拓也
文字サイズ
- 小
- 中
- 大
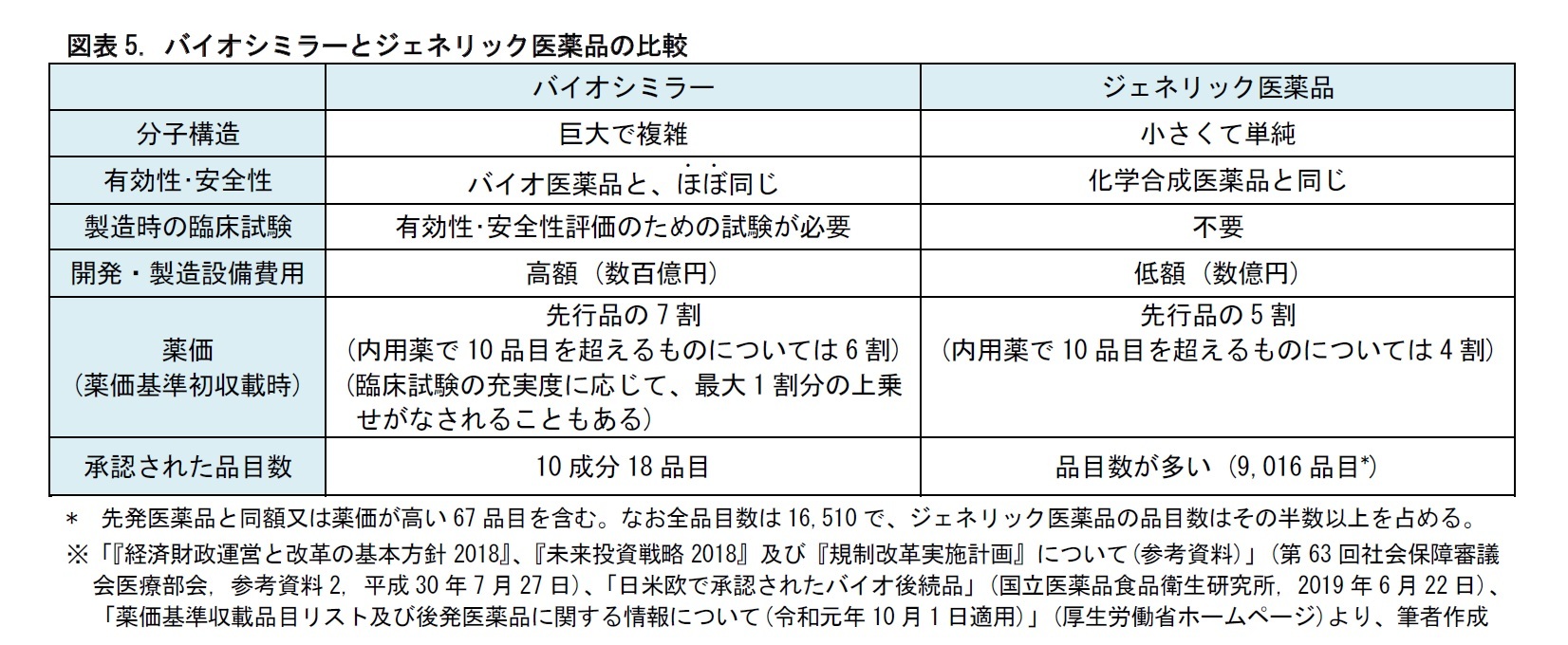
3――バイオシミラーとジェネリック医薬品の相違点
1|バイオシミラーは、先行品と有効性・安全性が全く同じというわけではない
バイオシミラーはバイオ医薬品と同様、微生物や動物細胞の機能を用いて、発酵、培養などにより製造される。一般に、発酵や培養の進み方は、気温、湿度、気圧などの条件によって影響を受ける。このため、先行品と同じ製法で製造しても、できあがるタンパク質が完全に同じとは限らない。つまり、バイオ医薬品は、先行品と品質特性や、有効性・安全性が全く同じというわけではない。これは、先行品と化学組成が完全に同じで、品質特性、有効性・安全性が先行品と変わらないとされる、ジェネリック医薬品とは異なる点である。
この結果、バイオシミラーは、開発時に先行品と同等・同質の有効性・安全性を持つことを臨床試験により確認しなくてはならないとされている。
バイオシミラーは、ジェネリック医薬品とは、製造にかかるコストが異なる。また、開発時には、臨床試験も必要となる。そのため、現在までに日本で承認されたバイオシミラーは、10成分18品目に限られている。これは、EUの14成分49品目、アメリカの12成分23品目の承認と比べて、少ない状況にある3。日本では、現在はバイオシミラー開発の黎明期にあるといえる。
先行品と同等・同質の有効性・安全性があり、先行品よりも安価であるというバイオシミラーの有益性を踏まえると、その開発・普及を進めていくことが必要な状況といえる。
3 「日米欧で承認されたバイオ後続品」(国立医薬品食品衛生研究所, 2019年6月22日)より。
4――バイオシミラーの普及のための検討ポイント
1|高額療養費制度や医療費助成制度により、患者がバイオシミラーを選択するインセンティブが乏しい
高額療養費制度により、患者の毎月の自己負担額には上限がある。そのため、先行品のバイオ医薬品でも、バイオシミラーでも、患者にとって自己負担額は変わらないという状態が生じる。
また、クローン病や潰瘍(かいよう)性大腸炎などの指定難病の患者に対しては、国の医療費助成制度が設けられている。患者の毎月の自己負担額の上限は1~2万円、上位所得者でも3万円となっている。この制度も、バイオシミラーを選択する患者のインセンティブを薄める要因となっている。
4 具体的には、腫瘍壊死因子TNF-αの病態形成における役割と作用機序の類似性、品質試験及び非臨床試験における高い類似性、関節リウマチ患者における臨床薬物動態・有効性の同等性、安全性プロファイルの差異に関する特段の懸念がないことの確認を指す。(図表6と同じ出典資料をもとに、筆者がまとめた)
これまで、バイオシミラーの開発・製造は、欧米のメーカーが先行している。現在日本で販売されているバイオシミラーは、ほとんどが輸入品である。このため、このままバイオシミラーの普及を拡大しても、国内で製造・品質管理のノウハウや技術の蓄積は進まないとみられる。政府は、日本の医薬品メーカーによるバイオシミラーの製造に向けて、創薬イノベーションを模索している段階にある。
5――おわりに (私見)
バイオ医薬品は、抗がん剤における免疫チェックポイント阻害薬にみられるように、従来の医療を劇的に変化させる可能性を有している。これから、バイオ医薬品の特許は、次々と満了の時期を迎える。特許満了後には、ジェネリック医薬品と同様に、バイオシミラーによる低価格化が進められていくものと思われる。その普及のためには、有効性・安全性に関する医療従事者の不安の緩和と、一般の人々の認知度を高めることが必要となろう。
引き続き、バイオ医薬品と、バイオシミラーを巡る各種の取り組みに、注目していきたい。
(2019年09月02日「基礎研レター」)

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員
篠原 拓也 (しのはら たくや)
研究・専門分野
保険商品・計理、共済計理人・コンサルティング業務
03-3512-1823
- 【職歴】
1992年 日本生命保険相互会社入社
2014年 ニッセイ基礎研究所へ
【加入団体等】
・日本アクチュアリー会 正会員
篠原 拓也のレポート
| 日付 | タイトル | 執筆者 | 媒体 |
|---|---|---|---|
| 2025/05/27 | 気候指数 2024年データへの更新-日本の気候の極端さは1971年以降の最高水準を大幅に更新 | 篠原 拓也 | 基礎研レポート |
| 2025/05/20 | 「次元の呪い」への対処-モデルの精度を上げるにはどうしたらよいか? | 篠原 拓也 | 研究員の眼 |
| 2025/05/13 | チェス盤を用いた伝心-愛情と計算力があれば心は通じる? | 篠原 拓也 | 研究員の眼 |
| 2025/05/09 | 国民負担率 24年度45.8%の見込み-高齢化を背景に、欧州諸国との差は徐々に縮小 | 篠原 拓也 | 基礎研マンスリー |
新着記事
-
2025年11月07日
フィリピンGDP(25年7-9月期)~民間消費の鈍化で4.0%成長に減速、電子部品輸出は堅調 -
2025年11月07日
次回の利上げは一体いつか?~日銀金融政策を巡る材料点検 -
2025年11月07日
個人年金の改定についての技術的なアドバイス(欧州)-EIOPAから欧州委員会への回答 -
2025年11月07日
中国の貿易統計(25年10月)~輸出、輸入とも悪化。対米輸出は減少が続く -
2025年11月07日
英国金融政策(11月MPC公表)-2会合連続の据え置きで利下げペースは鈍化
お知らせ
-
2025年07月01日
News Release
-
2025年06月06日
News Release
-
2025年04月02日
News Release
【バイオシミラーの普及-薬剤費抑制のためには、どういう取り組みが必要か?】【シンクタンク】ニッセイ基礎研究所は、保険・年金・社会保障、経済・金融・不動産、暮らし・高齢社会、経営・ビジネスなどの各専門領域の研究員を抱え、様々な情報提供を行っています。
バイオシミラーの普及-薬剤費抑制のためには、どういう取り組みが必要か?のレポート Topへ
















 各種レポート配信をメールでお知らせ。読み逃しを防ぎます!
各種レポート配信をメールでお知らせ。読み逃しを防ぎます!




