- シンクタンクならニッセイ基礎研究所 >
- 社会保障制度 >
- 医療保険制度 >
- 治験の概要-臨床試験の現状 (前編)
治験の概要-臨床試験の現状 (前編)

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員 篠原 拓也
0――はじめに
特に、近年は、バイオ医薬品をはじめとした、画期的な創薬が進んでいる。遺伝子技術を活用した、ゲノム創薬の研究も進められており、近い将来、医療のゲームチェンジャーとなることが期待されている。こうした新薬の開発では、臨床試験で安全性・有効性を確認することが欠かせない。
一方、2020年以降世界中で流行している新型コロナウイルス感染症に対する治療薬やワクチンの開発では、治験を完了して、製造・販売の承認に至るかどうかが重要なポイントとされてきた。このように、感染収束や重症化防止の切り札とされる医薬品開発で、治験の大切さに関心が集まっている。
それでは、そもそも臨床試験や治験とは、どういうものなのか? 「なんとなく聞いたことはあるが、詳しいところはよくわからない」という人が多いのではないだろうか。そこで、一般の人が理解を高めることを目指して、本稿(前編)と次稿(後編)の2回に分けて、臨床試験をテーマに、その現状をみていくこととしたい。
ただし、筆者は医師などの医療関係者ではない。治験を行う側はおろか、受ける側の被験者になったこともない。そこで、医学書等を参考に、理解した内容をまとめていくことを基本とする。もし、記載内容に誤り等があれば、ご指摘をいただければ幸いである。(参考にした書籍等は、稿末に、【参考文献・資料】として掲げている。)
本稿と次稿を通じて、読者の臨床試験への興味が高まれば幸いである。
1――治験とは
1|治験は、新薬承認を目的として行われる
そもそも「治験」という言葉の語源は、何なのだろうか? 何の略語なのだろうか? これについては、「治療の臨床試験」の略1とするものや、「治療試験」、「治療薬の開発のための試験」の略称とするものなど、諸説があり判然としないようだ2。
辞書で、「治験」を調べてみると、「治療の効果。また医薬品としての承認を得るために、臨床試験により薬物の効果を検定すること。」(「広辞苑第七版」(岩波書店))とある。「また」以下の、「医薬品としての承認を得るために」という部分が、この語釈のポイントといえそうだ。
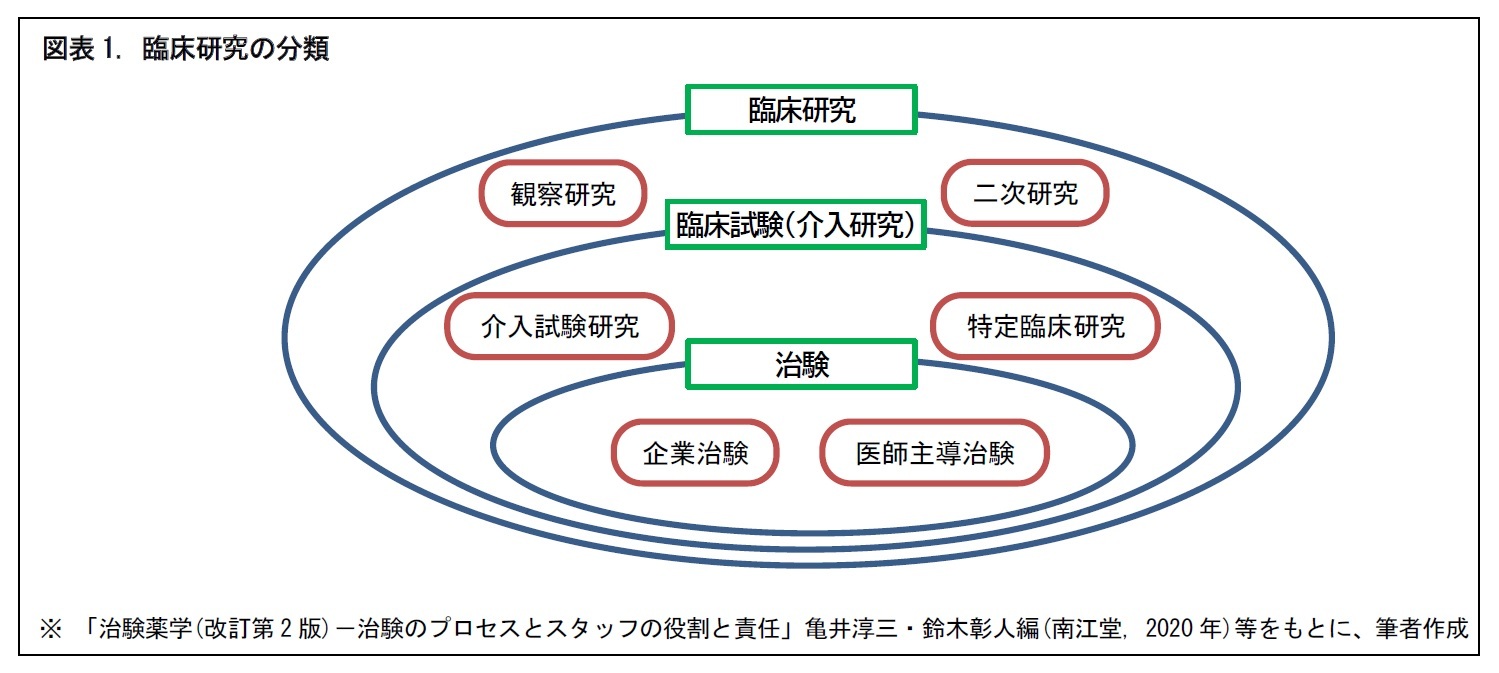
一般に、ヒトを対象として、疾病の診断、治療、予防方法の改善、さらに疾病の原因や病態を理解し、患者のQOL (Quality Of Life, 生活の質) の向上を目的として実施される医学研究のことを、「臨床研究」という。臨床研究には、次節で紹介するように、いくつかの種類がある。
そのうち、介入研究に位置づけられるものが「臨床試験」だ。臨床試験は、患者を含むヒトの集団に対して、新しい治療法・治療薬を用いて、その安全性と有効性を科学的に調べるものとなる。新しい治療薬の開発や、標準治療法の確立のために行われる。
そのうえで、「治験」は、主務官庁(厚生労働省)から、新薬や新たな治療法の承認を得ることを目的として、製薬企業や医師が主導して行う臨床試験をいう。つまり、承認を得るために行われる臨床試験が、治験ということになる。
治験は、「医薬品の臨床試験の実施の基準に関する省令」(GCP(Good Clinical Practice) 省令)を遵守して、被験者に対する倫理的な配慮を最優先して科学的に適正な方法で実施される3。
・製薬企業から研究の実施に必要となる資金の提供を受けて実施
・未承認または適応外の医薬品等を用いて実施
特定臨床研究の実施には、臨床研究法の基準4を遵守する義務が課される。
1 「治験って何のこと?」(エン転職 「転職大辞典」 https://employment.en-japan.com/tenshoku-daijiten/15017/)より。
2 「治験管理室だより」(東京慈恵会医科大学附属第三病院 治療管理室, 2005年夏号)での説明内容より。
3 治験には、(1)患者に対してこれまで全く使われたことのない新薬の臨床試験、(2)すでに他の疾患の治療には使用されているものの、その病気では使われたことがない薬の安全性や有効性の試験(適応拡大を目的とした臨床試験)、(3)海外で先行する臨床試験の結果を国内での承認に用いるためのブリッジング試験(後述)、がある。
4 具体的には、モニタリング・監査の実施や利益相反の管理等の実施基準の遵守、インフォームド・コンセントの取得、個人情報の保護、記録の保存等が義務付けられる。なお、臨床研究法は2017年に成立し、2018年から施行された。(「徹底研究『治験』と『臨床』-運用の視点・患者の視点で読み解く」公益財団法人 医療科学研究所監修(法研, 2018年)より)
前節で、臨床研究は、ヒトを対象として行われると述べた。その対象として、ヒトそのものだけではなく、ヒト由来の組織や細胞を使った研究も、臨床研究に含まれる。臨床研究ではない医学研究としては、化合物の毒性を調べたり、マウスやサルなどで動物実験を行ったりすることがあげられる。
一般に、臨床研究は、観察研究、介入研究、二次研究に大別される。
(1) 観察研究
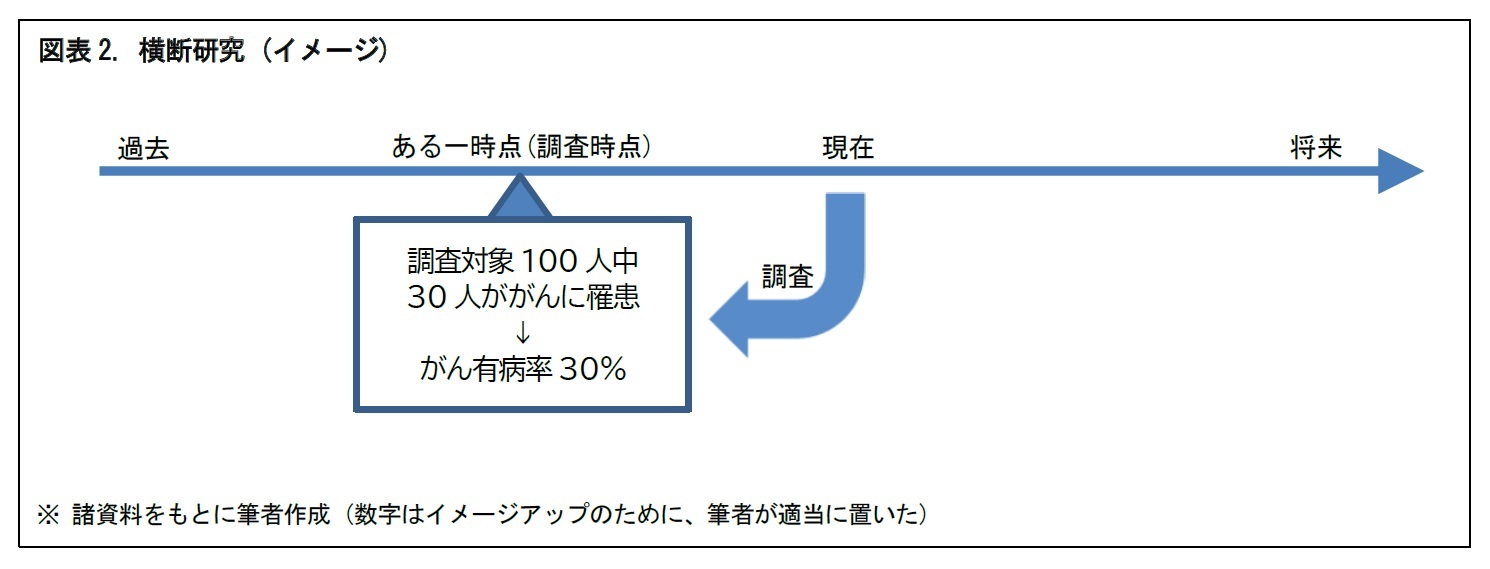
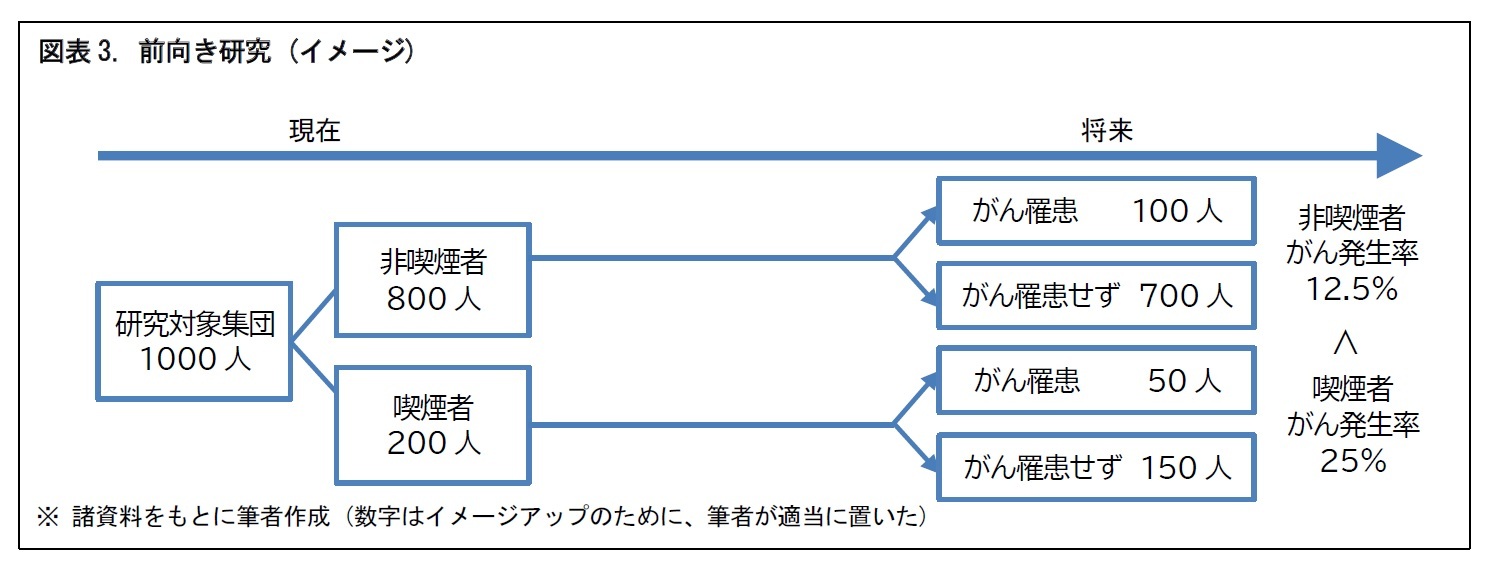
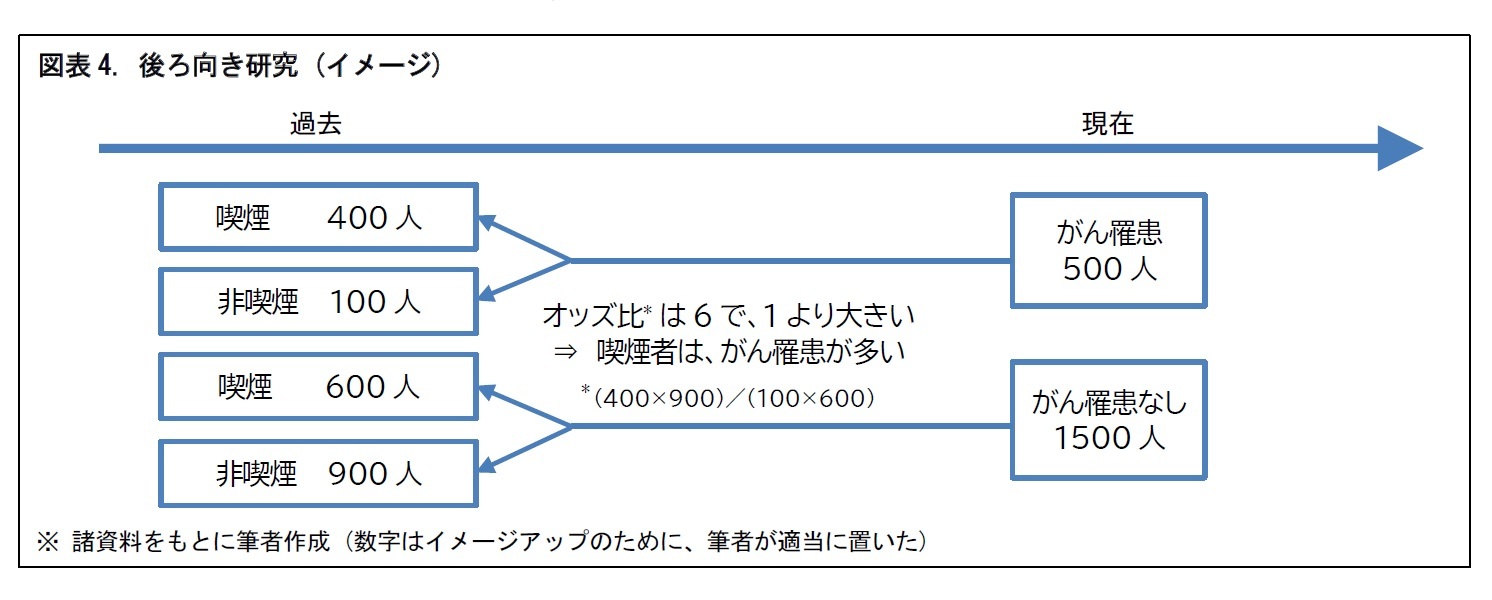
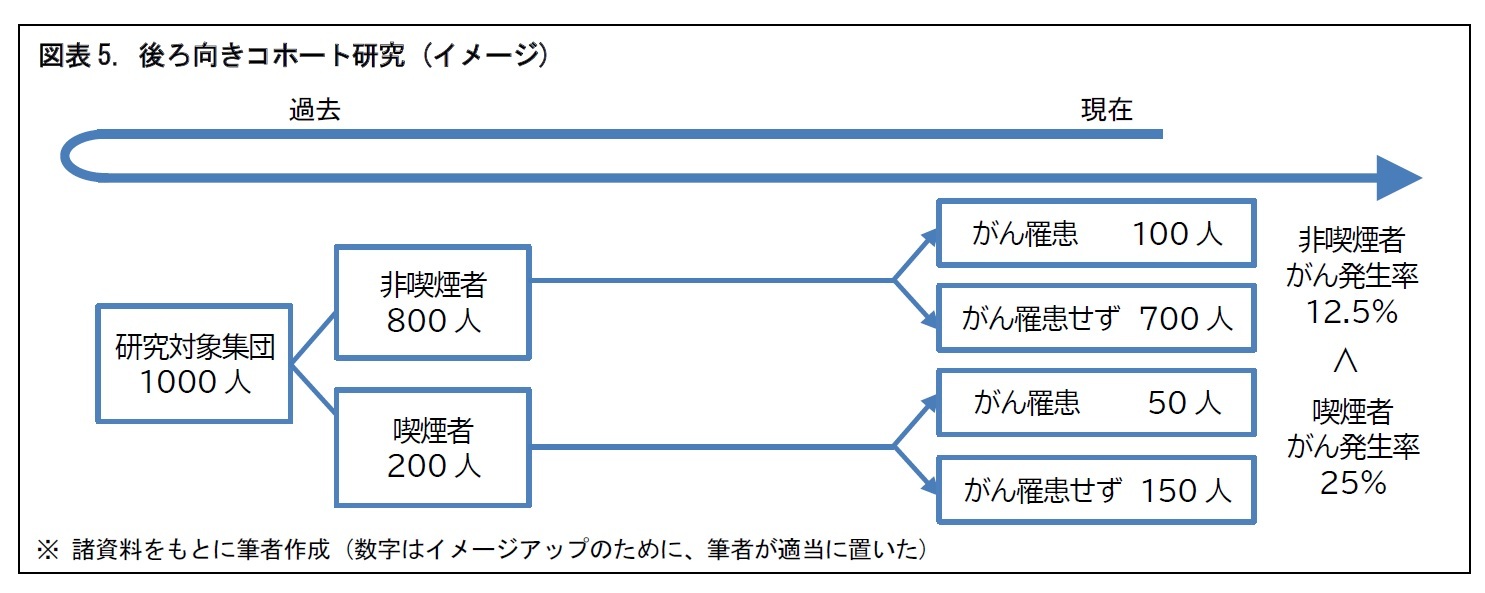
研究対象となる患者等を観察するもので、治療などの介入は行わない。既に行われた治療の効果や予後5を観察するものが一般的とされる。観察研究は、調査をある静止した一時点とするか、それとも経時的な調査とするか。経時的な調査とする場合には、時間軸の向きをどうするか、といった点の違いにより、「横断研究」、「前向き研究」、「後ろ向き研究」、「後ろ向きコホート研究」に分けることができる。それぞれ、図をもとに、簡単にみていこう。
5 (1)〔医〕(Prognose ドイツ)罹病した場合、その病気のたどる経過についての医学上の見通し。(2)俗に、病後の経過 (「広辞苑第七版」(岩波書店) より)
7 後ろ向きコホート研究は、罹患の有無の追跡を、後ろ向きできなく、前向きに行う。
(2) 介入研究
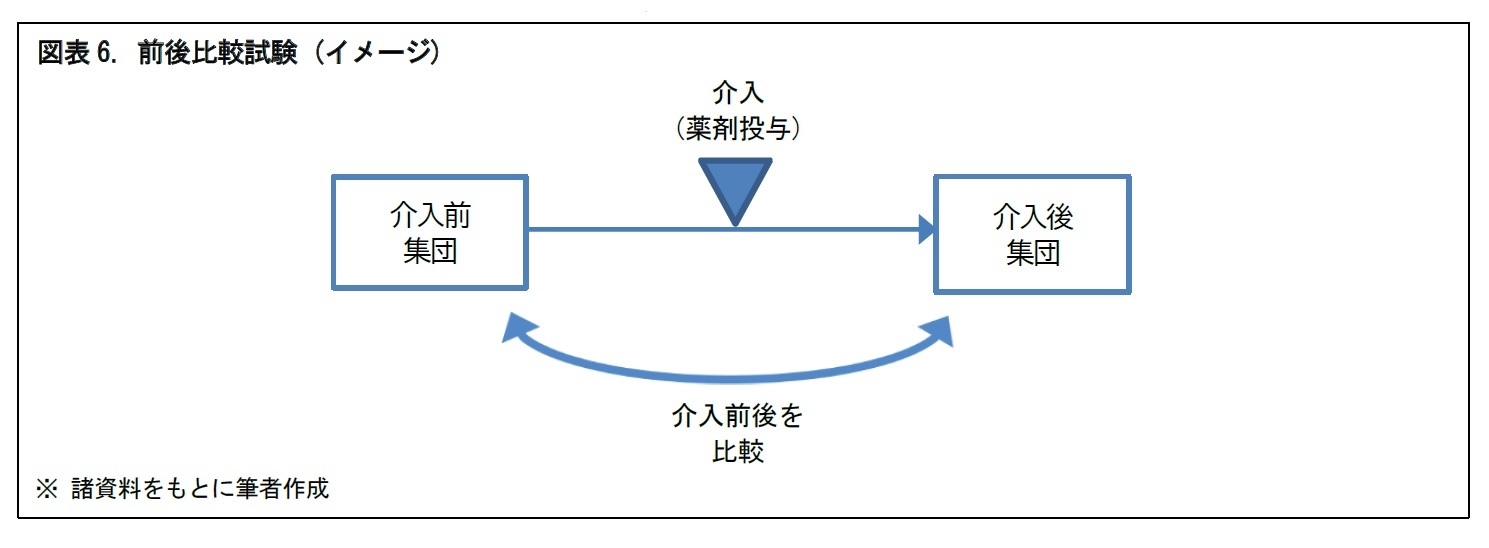
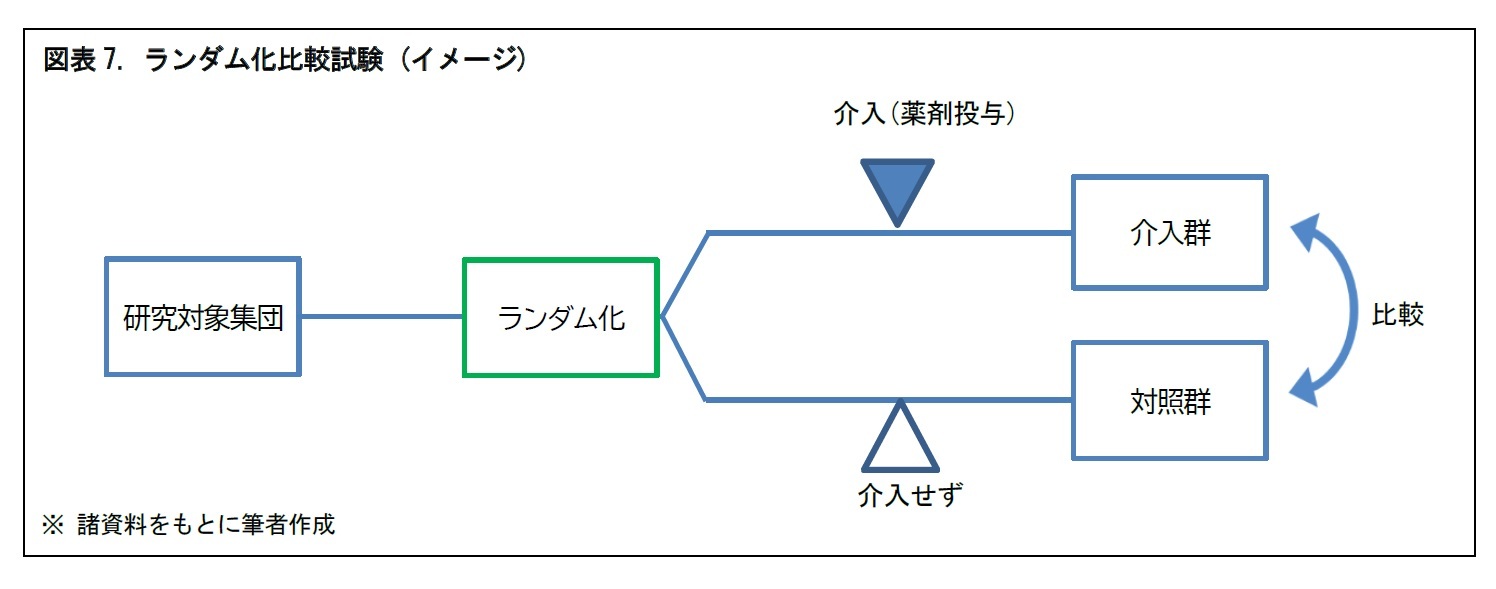
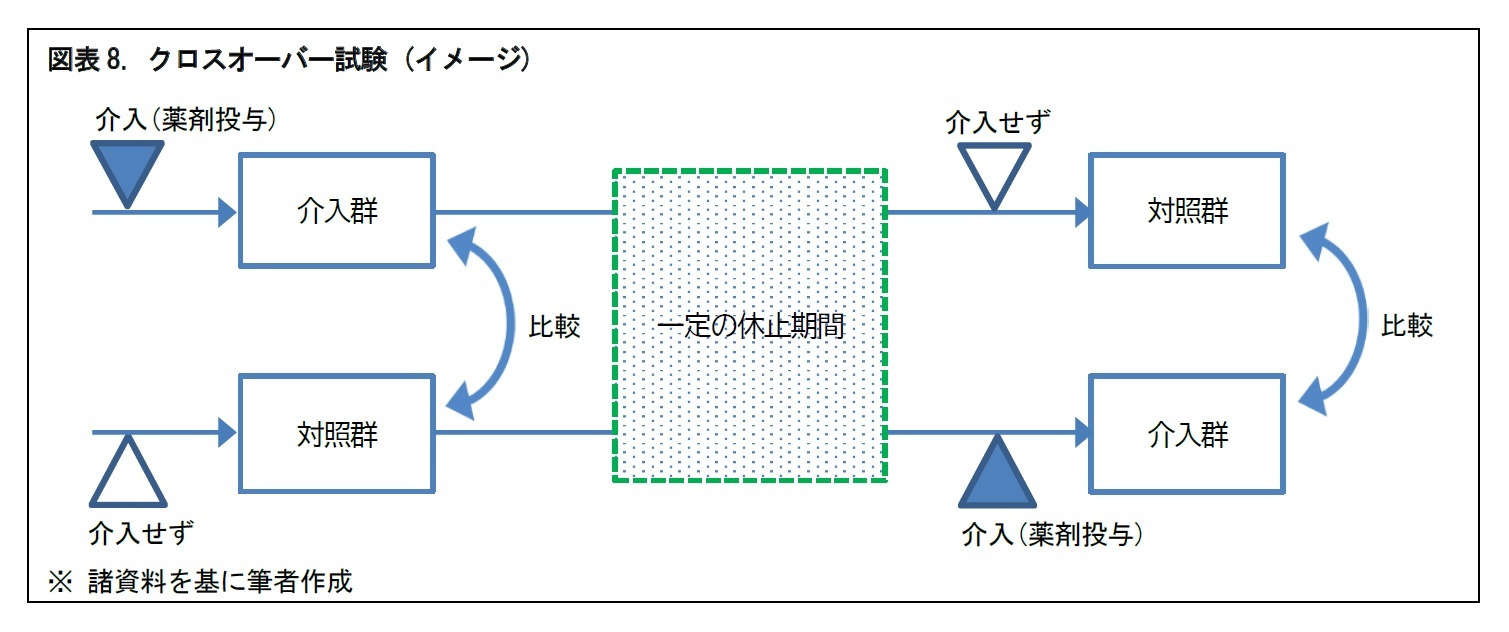
介入研究として、臨床試験が行われる。臨床試験は、患者を含むヒトの集団に対して、新しい治療法・治療薬を用いて、その安全性と有効性を科学的に調べるもの。新しい治療薬の開発や、標準治療法の確立のために行われる。臨床試験は、対照群を置くか、置かないか。対照群を置く場合に、一定期間後に介入群と対照群の入れ替えを行うかどうか、といった違いにより、「前後比較試験」、「ランダム化比較試験」、「クロスオーバー試験」に分けられる。
(e) 前後比較試験 : 介入前と介入後を比較することで、介入の影響を評価する。対照群を置かないため、結果が観察者の主観によって左右されやすいといわれる。多数の症例を集めることが困難な、希少疾患に対する医薬品開発などで、用いられることがある。
すでに医学誌等に掲載された過去の論文を多数集めて、それらを分析することで、再評価を行うもの。短時間に、費用をかけずに、多くの研究事例を収集・分析できるメリットがある。
一方、通常、医薬品の効果を示す肯定的な結果が得られた研究ほど、論文として掲載されやすいため、二次研究の結果には、偏り(「パブリケーション・バイアス」と呼ばれる)が混入してしまう欠点があるといわれる。
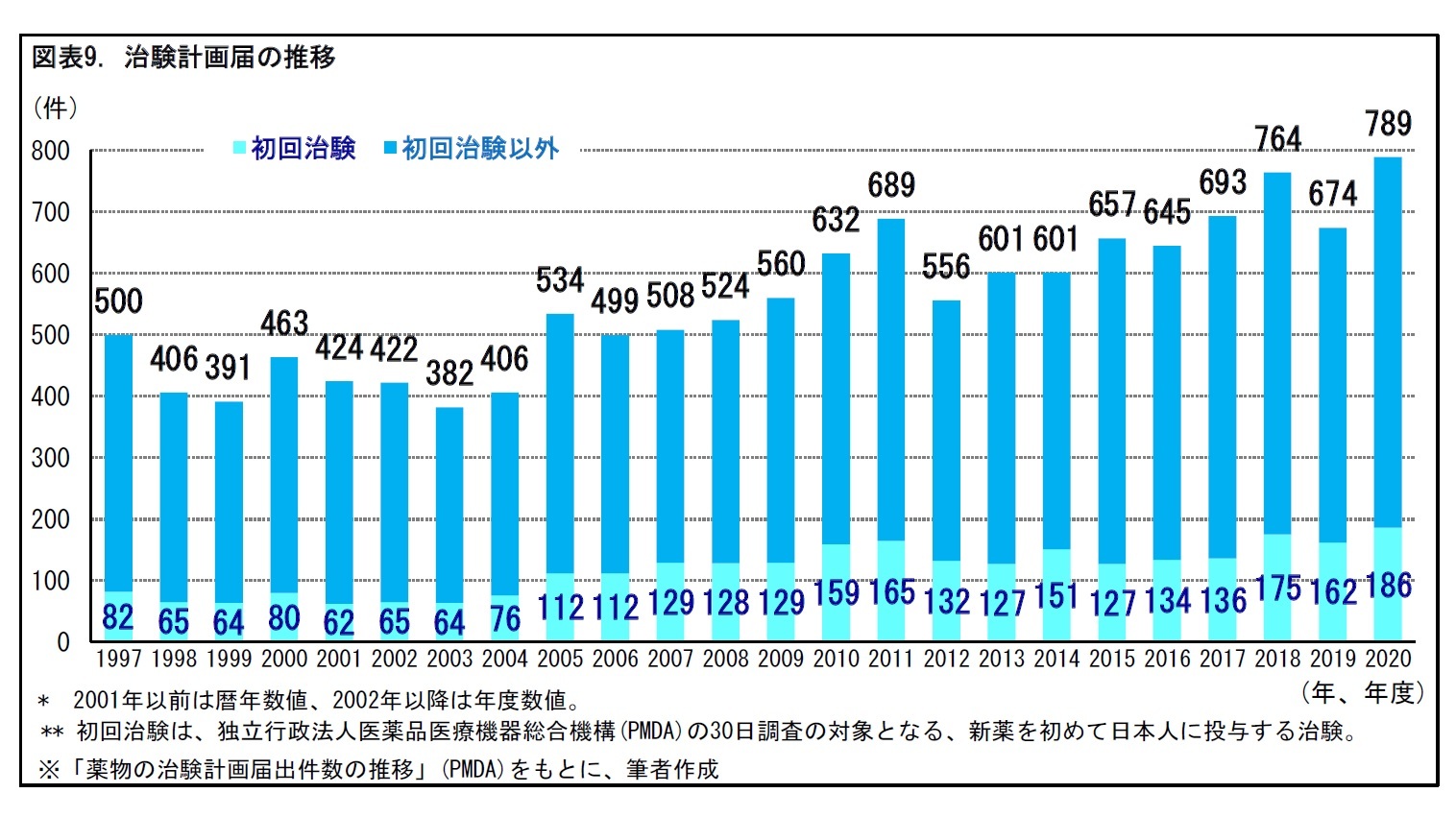
3|治験の届出数は、2000年代以降増加
日本では、治験を行う場合、事前に治験計画を厚生労働省に届け出る必要がある。過去20年あまりをみると、新薬を初めて日本人に投与する場合の初回治験、それ以外も含む治験全体のいずれも、2000年代以降、届出数が増加傾向にある。これは、治験数の減少を受けて、文部科学省・厚生労働省が共同で、2003年度より「全国治験活性化3ヵ年計画」(計画は1年延長され、2006年度まで実施)を推進したことなどによるものとみられる。2020年度には、初回治験だけで186件、治験全体では789件の届出が行われている。

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員
篠原 拓也 (しのはら たくや)
研究・専門分野
保険商品・計理、共済計理人・コンサルティング業務
03-3512-1823
- 【職歴】
1992年 日本生命保険相互会社入社
2014年 ニッセイ基礎研究所へ
【加入団体等】
・日本アクチュアリー会 正会員
公式SNSアカウント
新着レポートを随時お届け!日々の情報収集にぜひご活用ください。
新着記事
-
2024年04月23日
他国との再保険の監督に関する留意事項の検討(欧州)-EIOPAの声明 -
2024年04月23日
気候変動-温暖化の情報提示-気候変動問題の科学の専門家は“ドラマが少ない方向に誤る?” -
2024年04月23日
今後お金をかけたいもの・金融資産 -
2024年04月23日
今週のレポート・コラムまとめ【4/16-4/22発行分】 -
2024年04月22日
2024年3月、グローバル株式市場は上昇が継続
レポート紹介
-
研究領域
-
経済
-
金融・為替
-
資産運用・資産形成
-
年金
-
社会保障制度
-
保険
-
不動産
-
経営・ビジネス
-
暮らし
-
ジェロントロジー(高齢社会総合研究)
-
医療・介護・健康・ヘルスケア
-
政策提言
-
-
注目テーマ・キーワード
-
統計・指標・重要イベント
-
媒体
- アクセスランキング
お知らせ
-
2024年04月02日
News Release
-
2024年02月19日
News Release
-
2023年07月03日
News Release
【治験の概要-臨床試験の現状 (前編)】【シンクタンク】ニッセイ基礎研究所は、保険・年金・社会保障、経済・金融・不動産、暮らし・高齢社会、経営・ビジネスなどの各専門領域の研究員を抱え、様々な情報提供を行っています。
治験の概要-臨床試験の現状 (前編)のレポート Topへ















 各種レポート配信をメールでお知らせ。読み逃しを防ぎます!
各種レポート配信をメールでお知らせ。読み逃しを防ぎます!





