- シンクタンクならニッセイ基礎研究所 >
- 社会保障制度 >
- 医療保険制度 >
- 医薬品・医療機器の現状 2015年度総まとめ
医薬品・医療機器の現状 2015年度総まとめ

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員 篠原 拓也
2―― 新薬の開発
まず、新薬開発の略史から見ていくこととする。
1|新薬開発の略史
日本の新薬開発の歴史は古い。奈良時代には薬草を用いた療養が行われていた。17世紀には植物、動物、鉱物などの薬効成分を配合した漢方薬が広く取り扱われた。明治期には西洋からの輸入薬の取扱いが中心となり、大正期に入る頃には国産化が始まった。第2次大戦後には、結核等の感染症対策として抗生物質が導入された。法制面では、1950年には薬価基準制度が始まり、1960年には薬事法が制定された。1961年の国民皆保険制度の完成により、医療用医薬品の市場が拡大した。
近年は、薬物治療法の進歩がめざましい。高血圧、高脂血症、糖尿病の生活習慣病に対して、有効で副作用の小さい医薬品が開発されている。胃潰瘍の医薬品導入や、ピロリ菌対策なども進んでいる。また、関節リウマチ、潰瘍性大腸炎、クローン病等の自己免疫系疾患も薬物治療法が進み、通院での治療が可能となっている。
現在は、がんや認知症などで新薬開発の動きがあり、その動向に注目が集まっている。予防医療のためのワクチンの開発や、iPS細胞やES細胞などの研究成果を再生医療に実用化しようとする取組みも進んでいる。このように、更なる医薬品業界の挑戦が続いている。
2|後発薬についての取り組み
最近、医薬品費の節減を通じた医療費の削減が、社会保障関連の議論の中で取り上げられることが多い。特に、後発薬への切り替えが広く論じられている。まず、後発薬の概要から見ることとしたい。
(1)後発薬の概要
医薬品は、特許の面から、新薬、長期収載品、後発薬の3つに分けることができる。新薬は発売から5~10年程度、特許を伴って販売される。長期収載品は、新薬の特許が切れた後に薬価基準22に収載されたままになっている医薬品を指す。後発薬は、新薬と同様の薬効をもつ医薬品で、特許の切れた新薬からの置き換えを狙って、新薬よりも低価格で市場に投入される。欧米では、新薬の特許が切れると、速やかに後発薬に切り替えられるため、長期収載品が使用されることはほとんどない。一方、日本では、長期収載品が使われ続けることが多い。
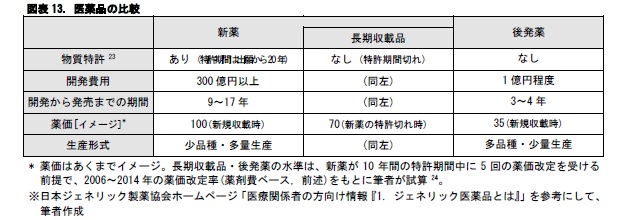
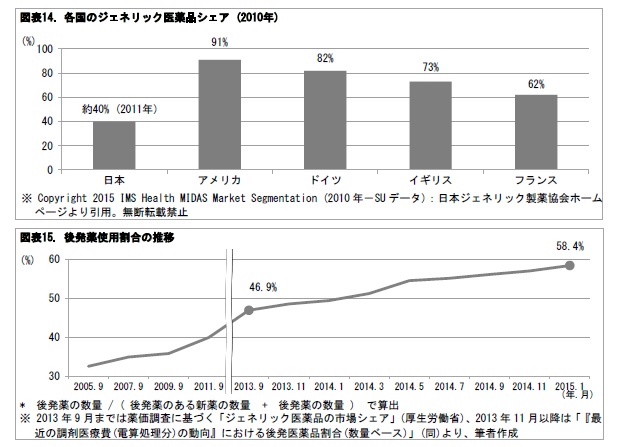
経済財政諮問会議等では、後発薬の普及率が欧米諸国に比べて低い点が取りざたされてきた。これまで、政府は2017年度末で後発薬の数量ベースの使用割合を60%とする目標を掲げてきた。2013年9月の薬価調査時には、使用割合は46.9%であった。この割合は、2015年1月には58.4%に上昇している。政府が2015年6月30日に閣議決定した「経済財政運営と改革の基本方針2015」(骨太の方針)では、後発薬の数量シェアの目標値を、2017 年央に70%以上とするとともに、2018年度から2020 年度末までの間のなるべく早い時期に80%以上とすること。2017 年央において、その時点の進捗評価を踏まえて、80%以上の目標の達成時期を具体的に決定することが、打ち出されている。
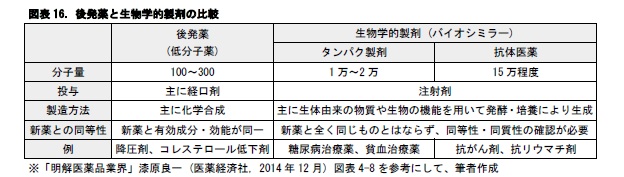
後発薬は低分子薬であるが、これとは別に、近年、生物学的製剤も開発されるようになった。
低分子薬は、現在一般にジェネリック医薬品として処方されているもので、主に化学合成で作られる経口剤が多い。新薬と有効成分が同じで、同一の効能を示す。一方、生物学的製剤は、発酵や培養といった生物の機能を使って作られるもので、注射剤として開発される。発酵や培養の際の温度等の条件が異なるため、新薬と全く同じ医薬品ができる訳ではない。このため、類似品を表すシミラーという用語を用いて、バイオシミラーとも呼ばれている。バイオシミラーは、これまでタンパク製剤25の開発が中心であったが、今後は、がんやリウマチなどの抗体医薬26として、より分子量が大きい医薬品が開発されていく見通しである。
バイオシミラーは、後発薬と異なり、培養棟などの大がかりな開発設備を要する。このため、ジェネリック専業メーカーよりも、むしろ新薬メーカーの方が手がけやすいと考えられる。現在、大手新薬メーカーや、その関連のベンチャー企業を中心に開発が進められている模様である。
22 各医薬品の薬価をまとめた価格表のこと。2015年6月現在、薬価基準に載っている医療用医薬品は、内用薬、外用薬、注射薬等を合わせて約1.5万品目に上る。薬価基準への新規収載は、新薬は年に4回、後発薬は年に2回行われる。一方、処方頻度が少ない古い薬で、製造販売が中止されると、薬価基準から削除される。
23 有効成分の特許のこと。他に、製法特許(製造方法の特許)、用途特許/医薬特許(効能効果の特許)、製剤特許(用法用量の特許)がある。通常、特許出願は臨床試験の前に行われるため、その後の開発・審査に10~15年かかることを踏まえると、販売から5~10年程度で特許期間切れとなる。なお、製薬会社が申請すれば、5年を上限に特許期間の延長が認められる。
24 この試算では、後発薬の新規収載時の薬価は、長期収載品の5割としている。算定ルール上、後発薬の新規収載時は新薬の6割 (内用薬で収載希望品目数が10を超える場合は5割)で算定する。新薬が新薬創出加算(後述)の対象の場合、加算分を差し引いた薬価から算定する。バイオ後発薬の場合は、上述の6割を7割、5割を6割とそれぞれ読み替えて算定する。
25 体内にある遺伝子を無性増殖させて開発した医薬品。疾病等により体内の成分が不足した場合に投与して体内機能を保つ。
26 抗体の免疫機能(特定の異物にある抗原に特異的に結合し、その異物を生体内から除去する)を活用した医薬品。

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員
篠原 拓也 (しのはら たくや)
研究・専門分野
保険商品・計理、共済計理人・コンサルティング業務
03-3512-1823
- 【職歴】
1992年 日本生命保険相互会社入社
2014年 ニッセイ基礎研究所へ
【加入団体等】
・日本アクチュアリー会 正会員
公式SNSアカウント
新着レポートを随時お届け!日々の情報収集にぜひご活用ください。
新着記事
-
2024年04月16日
金融分野におけるグリーンウォッシングの規制にむけて(欧州)-EIOPAと欧州保険協会の意見表明 -
2024年04月16日
山を分けていく問題-得られた答えをどのように解釈する? -
2024年04月16日
引き続き高成長が予想されるインド保険市場-2022年の生保収入保険料は前年の世界第9位から第7位に浮上- -
2024年04月16日
Googleの運用型広告訴訟-米国司法省等から競争法違反との訴え -
2024年04月16日
今週のレポート・コラムまとめ【4/9-4/15発行分】
レポート紹介
-
研究領域
-
経済
-
金融・為替
-
資産運用・資産形成
-
年金
-
社会保障制度
-
保険
-
不動産
-
経営・ビジネス
-
暮らし
-
ジェロントロジー(高齢社会総合研究)
-
医療・介護・健康・ヘルスケア
-
政策提言
-
-
注目テーマ・キーワード
-
統計・指標・重要イベント
-
媒体
- アクセスランキング
お知らせ
-
2024年04月02日
News Release
-
2024年02月19日
News Release
-
2023年07月03日
News Release
【医薬品・医療機器の現状 2015年度総まとめ】【シンクタンク】ニッセイ基礎研究所は、保険・年金・社会保障、経済・金融・不動産、暮らし・高齢社会、経営・ビジネスなどの各専門領域の研究員を抱え、様々な情報提供を行っています。
医薬品・医療機器の現状 2015年度総まとめのレポート Topへ















 各種レポート配信をメールでお知らせ。読み逃しを防ぎます!
各種レポート配信をメールでお知らせ。読み逃しを防ぎます!





