- シンクタンクならニッセイ基礎研究所 >
- 社会保障制度 >
- 医療保険制度 >
- 医薬品・医療機器の現状 2015年度総まとめ
医薬品・医療機器の現状 2015年度総まとめ

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員 篠原 拓也
(2-1) 医療機器の保険価格の設定の仕組み
通常、保険診療で用いられる、法令で承認・認証を受けた医療機器(「保険医療材料」と呼ばれる。)に関する価格は、診療報酬の中の手技料等に包括的に含まれているため、別途算定することはできない。しかし、特定の医療機器については、「特定保険医療材料」として別に算定される。特定保険医療材料は、医薬品の薬価と同様に、公定価格が定められている。これは、厚生労働省から告示され、診療報酬にもその点数が収載されている。特定保険医療材料には、診療(検査・画像診断・注射・処置・手術・麻酔)の際に医師が使用する医療機器や、在宅医療や保険薬局で患者に支給されるもの(例えば、 万年筆型注入器用注射針)などがある。特定保険医療材料として算定するためには、対象となる病態などの条件が付されることもある。
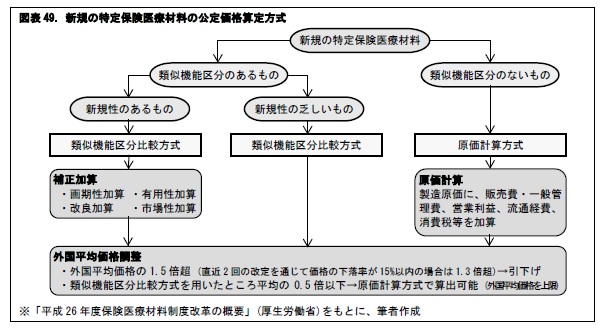
新機能や新技術をもつ新規の特定保険医療材料については、以下に述べる「類似機能区分比較方式」や「原価計算方式」を用いて、公定価格が設定される。

(a)類似機能区分比較方式
既存の特定保険医療材料に類似機能区分のある特定保険医療材料を開発する場合、類似機能区分比較方式がとられる。
特定保険医療材料に新規性があれば、既存の特定保険医療材料の公定価格に、補正加算として、画期性、有用性、改良、市場性に応じた加算を行う。その上で、アメリカ、イギリス、ドイツ、フランス、オーストラリアにおける価格の平均額との乖離が大きい場合、その平均額を踏まえて外国平均価格調整を行う。
特定保険医療材料の新規性が乏しければ、補正加算はせずに、外国平均価格調整のみを行う。
(b)原価計算方式
既存の特定保険医療材料に類似機能区分のない特定保険医療材料を開発する場合、原価計算方式がとられる。この方式では、原材料費、労務費、製造経費から製造原価を算定する。これに、販売費・一般管理費、営業利益72、流通経費、消費税等を上乗せして公定価格が算定される。
(2-2) 内外価格差の解消への取組み
医療機器の保険価格の設定に関連して、「内外価格差問題」が取りざたされることが多い。この問題は、日本の医療機器の公定価格が海外の価格よりも高いために、医療費が高止まりする要因となっているとするものである。実際に、いくつかの特定保険医療材料で比較すると、日本の機器の価格は高い水準にある。
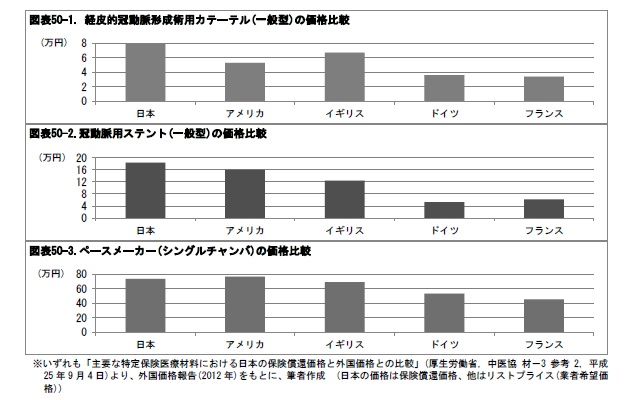
内外価格差の原因として、国内外における医療機器の流通実態の違いが指摘されている。価格差の解消を目指して、2014年度の診療報酬改正で、外国平均価格調整における外国平均価格について、参照国間で価格の開きが大きいケースの取扱いなどを詳細に定めるように変更73して、特定医療保険材料の価格反映の適正化が図られている。厚生労働省の部会では、日本と他の先進国における医療機器の供給・流通等の状況について、2015年度以降調査を行うこととしている。
(2-3) デバイスラグへの対応
医薬品におけるドラッグラグと同様に、医療機器においても、海外で導入済みの機器が日本では導入できないという、「デバイスラグ」の問題がある。申請(開発)ラグの解消がなかなか進まないことが、その原因となっている。
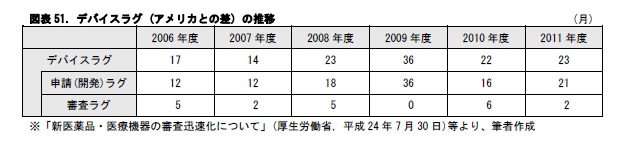
医療機器は、医療機器規制国際整合化会議(GHTF74)により、リスクに応じて4つのクラスに分類され、それぞれに異なった規制が行われている。日本では、クラスⅢおよびクラスⅣに該当する医療機器を高度管理医療機器と分類して、医薬品医療機器総合機構(PMDA)での審査や厚生労働大臣の承認が必要とされている。

2014年の薬機法施行に伴い、コンタクトレンズ、歯科インプラント、インスリンペン型注入器などのクラスIIIの一部の機器は、管理用医療機器(クラスⅡ)と同様、民間の第三者認証制度を活用できることとされた。これにより、PMDAは高リスクの医療機器の審査に集中でき、審査の効率化による迅速化が期待されている。現在、厚生労働省の「医療ニーズの高い医療機器等の早期導入に関する検討会」で、国内未承認又は適応外の医療機器や体外診断用医薬品について、医療ニーズの高いものを選定し、迅速な医療現場への導入に向けて検討・承認をしている75。2015年6月に開催された同会では、欧米で未承認の医療機器であっても、医師主導治験を実施中もしくは終了しているものや、優れた試験成績が論文等で公表されているものなど一定の要件を満たし、医療上特に必要性が高いと認められるものであれば、要望品目の対象に加えることが議論された。このように、デバイスラグの解消に向けて、ニーズ検討の取組みが進められている。
72 なお、営業利益には、業界の実情を踏まえつつ、新規収載品の革新性の度合いに応じて-50%~+100%の範囲内で調整(「イノベーションの評価」)が行われる。
73 外国平均価格は、アメリカ、イギリス、ドイツ、フランス、オーストラリアの医療材料の価格を平均した額とする。ただし、次に該当する場合は、当該価格を外国平均価格とする。(1)価格が2カ国以上あり、最高価格が最低価格の3倍を上回る場合は、当該最高価格を除外して平均した額、(2)価格が3ヵ国以上あり、そのうち最高価格がそれ以外の価格の平均額の2倍を上回る場合は、当該最高価格をそれ以外の価格の平均額の2倍相当とみなして平均した額。
74 GHTFは、Global Harmonization Task Forceの略。日米欧、オーストラリア、カナダの5地域の規制当局や産業界代表者が参加して、医療機器の規制について議論する会議。1992年創設。
75 2006年度の開始以来、学会等から358 件の要望があり、そのうち70 件(117 品目)を選定し、59 品目を承認した。

保険研究部 主席研究員 兼 気候変動リサーチセンター チーフ気候変動アナリスト 兼 ヘルスケアリサーチセンター 主席研究員
篠原 拓也 (しのはら たくや)
研究・専門分野
保険商品・計理、共済計理人・コンサルティング業務
03-3512-1823
- 【職歴】
1992年 日本生命保険相互会社入社
2014年 ニッセイ基礎研究所へ
【加入団体等】
・日本アクチュアリー会 正会員
公式SNSアカウント
新着レポートを随時お届け!日々の情報収集にぜひご活用ください。
新着記事
-
2024年04月23日
他国との再保険の監督に関する留意事項の検討(欧州)-EIOPAの声明 -
2024年04月23日
気候変動-温暖化の情報提示-気候変動問題の科学の専門家は“ドラマが少ない方向に誤る?” -
2024年04月23日
今後お金をかけたいもの・金融資産 -
2024年04月23日
今週のレポート・コラムまとめ【4/16-4/22発行分】 -
2024年04月22日
2024年3月、グローバル株式市場は上昇が継続
レポート紹介
-
研究領域
-
経済
-
金融・為替
-
資産運用・資産形成
-
年金
-
社会保障制度
-
保険
-
不動産
-
経営・ビジネス
-
暮らし
-
ジェロントロジー(高齢社会総合研究)
-
医療・介護・健康・ヘルスケア
-
政策提言
-
-
注目テーマ・キーワード
-
統計・指標・重要イベント
-
媒体
- アクセスランキング
お知らせ
-
2024年04月02日
News Release
-
2024年02月19日
News Release
-
2023年07月03日
News Release
【医薬品・医療機器の現状 2015年度総まとめ】【シンクタンク】ニッセイ基礎研究所は、保険・年金・社会保障、経済・金融・不動産、暮らし・高齢社会、経営・ビジネスなどの各専門領域の研究員を抱え、様々な情報提供を行っています。
医薬品・医療機器の現状 2015年度総まとめのレポート Topへ















 各種レポート配信をメールでお知らせ。読み逃しを防ぎます!
各種レポート配信をメールでお知らせ。読み逃しを防ぎます!





